Xenontetrafluorid
Xenontetrafluorid ist eine der wenigen Edelgasverbindungen und eine der zuerst (1962) entdeckten aus zwei Elementen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
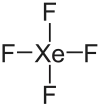 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Xenontetrafluorid | ||||||||||||||||||
| Andere Namen |
Xenon(IV)-fluorid | ||||||||||||||||||
| Summenformel | XeF4 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 207,28 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,04 g·cm−3[1] | ||||||||||||||||||
| Sublimationspunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
Hydrolyse in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Xenontetrafluorid kann durch Reaktion der Elemente Xenon und Fluor bei 400 °C und 6 bar[5][2] oder durch Reaktion von Xenon mit Sauerstoffdifluorid hergestellt werden.
Die Standardbildungsenthalpie der exothermen Reaktion beträgt −278 kJ·mol−1.[5] Die Verbindung lässt sich auch durch die Fluorierung von Xenondifluorid gewinnen.[6]
Eigenschaften

Physikalische Eigenschaften
Xenontetrafluorid hat eine quadratisch-planare Molekülstruktur.[5]
Bei Normaldruck und einer Temperatur von 115,75 °C geht es durch Sublimation direkt vom festen in den gasförmigen Zustand über.[1] Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im Gleichgewicht stehen, liegt bei einer Temperatur von 117,10 °C[1][7] und einem Druck von 1,082 bar.[7] Die Sublimationsdruckfunktion ergibt sich entsprechend log10(P) = −A/T−B·log10(T)+C (P in Torr, T in K) mit A = 3226,27, B = 0,43434 und C = 12,301738 im Temperaturbereich von 275 bis 390 K.[7] Hier ergibt sich mittels einer Auswertung nach Clausius-Clapeyron eine Sublimationsenthalpie von 60,6 kJ·mol−1.[7] Die kritische Temperatur beträgt 339 °C, der kritische Druck 70,4 bar, die kritische Dichte 1,10 g·cm−3 und das kritische Volumen 189 cm3·mol−1.[8] Der Xenon-Fluor-Abstand beträgt im gasförmigen Zustand 194 pm, im Kristall 195,3 pm.[9]
Chemische Eigenschaften
Xenontetrafluorid ist unter normalen Bedingungen stabil, hydrolysiert aber bei Kontakt mit Wasser zu Xenontrioxid.
Die Verbindung ist ein starkes Oxidationsmittel. So wird metallisches Platin zu Platin(IV)-fluorid und metallisches Quecksilber zu Quecksilber(I)-fluorid oxidiert.[6] Durch Wasserstoff wird es zu Xenon und Fluorwasserstoff reduziert.[6]
Es reagiert heftig mit organischen Ethern wie Tetrahydrofuran und Dioxan.[6] Bei Kontakt mit brennbaren Stoffen, wie Aceton oder Leichtmetallpulver kann die Verbindung explosionsartig reagieren.[10]
Verwendung
Durch Lösen mit Antimonpentafluorid SbF5 in Flusssäure HF kann Xenontrifluoridohexafluoroantimonat(V) gewonnen werden.[11]
Siehe auch
- Xenondifluorid XeF2
- Xenonhexafluorid XeF6
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-98. (Xenontetrafluorid bei WebElements).
- J. G. Malm and C. L. Chernick: Xenon tetrafluoride. In: Henry F. Holtzclaw, Jr. (Hrsg.): Inorganic Syntheses. Band 8. McGraw-Hill Book Company, Inc., 1966, S. 254–258 (englisch).
- John L. Huston: Chemical and physical properties of some xenon compounds; doi:10.1021/ic00132a043.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Riedel, E.; Janiak, C.: Anorganische Chemie, 9. Auflage, 2015 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-035528-4, S. 416–417, (abgerufen über De Gruyter Online)
- Wiberg, E.; Wiberg, N.; Holleman, A.F.: Anorganische Chemie, 103. Auflage, 2017 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-026932-1, S. 467, (abgerufen über De Gruyter Online).
- Schreiner, F.; McDonald, G.N.; Chernick, C.L.: Vapor pressure and melting points of xenon difluoride and xenon tetrafluoride in J. Phys. Chem. 72 (1968) 1162–1166, doi:10.1021/j100850a014.
- Ogrin, T.; Zemva, B.; Bohinc, M.; Slivnik, J.: Critical Constants and Liquid Densities of Xenon Difluoride and Xenon Tetrafluoride in J. Chem. Eng. Data 17 (1972) 418–419, doi:10.1021/je60055a003.
- Eintrag zu Xenon-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2018.
- L. Roth, U. Weller: Gefährliche Chemische Reaktionen, Eintrag für Xenontetrafluorid, Stand 72. Ergänzungslieferung 3/2014, ecomed Verlag Landsberg/Lech, ISBN 978-3609195872.
- P. Boldrini, R. J. Gillepsie, P. R. Ireland, G. J. Schrobilgen: Crystal structure of trifluoroxenon(1+) hexafluoroantimonate(1-). In: Inorganic Chemistry. Juli 1974, S. 1690, doi:10.1021/ic50137a030.