Trinorbornan
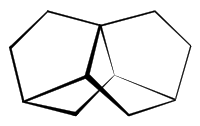
Trinorbornan ist ein tetracylischer, gesättigter Kohlenwasserstoff, der aus Cyclopentan- und Cyclohexan-Ringen aufgebaut ist. Der Name der Verbindung ergibt sich aus den drei Norbornan-Strukturelementen, die im Molekül vorhanden sind.[1] Die Bezeichnung Trinorbornan sollte nicht mit der Alternativbezeichnung für Norbornan, 8,9,10-Trinorbornan, verwechselt werden.[3]

| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Allgemeines | |||||||
| Name | Trinorbornan | ||||||
| Andere Namen |
Tetracyclo[5.2.2.01,6.04,9]undecan (IUPAC) | ||||||
| Summenformel | C11H16 | ||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 148,24 g·mol−1 | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Synthese
Die Synthese von Trinorbornan in einer mehrstufigen Reaktionssequenz wurde 2017 publiziert.[1]
Zunächst wird Malonsäuredimethylester 1 unter basischen Bedingungen in DMF bei Raumtemperatur mit (E)-4-Chlor-3-methoxy-2-butensäuremethylester 2 umgesetzt. Der resultierende (E)-3-Methoxy-3-buten-1,1,4-tricarbonsäuremethylester 3 wird in einer Lösung von Natriummethanolat in Methanol bei 60 °C zum 4-Methoxy-2-oxo-cyclopent-3-encarbonsäuremethylester 4 cyclisiert.
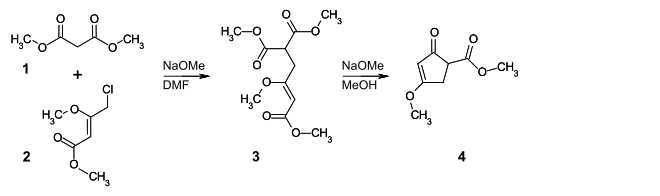
Durch Deprotonierung des Cyclopentenon-Derivats 4 mit Kaliumhydrid in DMF erfolgt mit 4-Brom-1-buten 5 die Alkylierung zum 1-(But-3-enyl)-4-methoxy-2-oxo-cyclopent-3-encarbonsäuremethylester 6. Die Verseifung der Estergruppe, gefolgt von einer Decarboxylierung wird durch Umsetzung mit Kaliumhydroxid in Ethanol unter Rückfluss durchgeführt. Gleichzeitig wird die Methoxygruppe in eine Ethoxygruppe überführt und man erhält 5-(But-3-enyl)-3-ethoxycyclopent-2-enon 7. Die Verbindung 7 wird mit Lithiumdiisopropylamid (LDA) bei −78 °C deprotoniert und bei 0–25 °C in Gegenwart von 1,3-Dimethyl-2-imidazolidinon (DMI) mit Phenylvinylsulfon 8 im Sinne einer Michael-Addition zur Verbindung 9 umgesetzt.
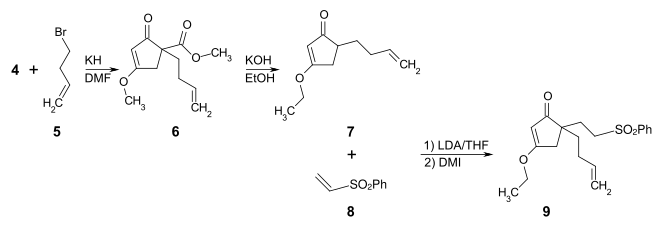
Mit Diisobutylaluminiumhydrid (DIBAL-H) in Toluol gelingt die selektive Reduktion zum 4-(But-3-en1-yl)-4-(2-(phenylsulfonyl)ethyl)cyclopent-2-enon 10. Unter den Bedingungen der Luche-Reduktion wird mit Cer(III)-chlorid und Natriumborhydrid das Cyclopentenon-Strukturelement von 10 zu dem entsprechenden Cyclopenten-2-ol reduziert. Ohne Zwischenisolierung wird dieses dehydratisiert, wobei das entstehende Cyclopentadien-Derivat mit der 3-Buten-Seitenkette im Sinne einer intramolekularen Diels-Alder-Reaktion zur Verbindung 11 cyclisiert. Im letzten Schritt wird die Phenylsulfongruppe mit Samarium(II)-iodid unter Bildung einer 2-Ethyl-Radikal-Einheit reduziert. Diese cyclisiert zur Zielverbindung 12.
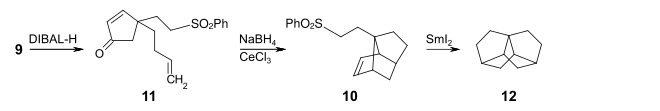
Die isolierte Ausbeute über alle Stufen beträgt 7 %.
Eigenschaften
Trinorbornan ist ein Beispiel für eine Verbindung, die eine axiale Chiralität aufweist. Das Molekül besitzt eine C2-Symmetrie.
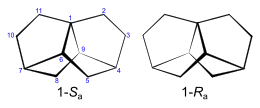
Das Kohlenstoffatom in der 1-Position befindet sich auf der Chiralitätsachse des Moleküls, so dass man von einem 1-Sa und einem 1-Ra-Enantiomer sprechen kann. Daneben gibt es im Molekül noch vier weitere Chiralitätszentren (C-4,6,7,9), die jedoch bei beiden Enantionmeren die identische Konfiguration aufweisen. Die IUPAC-Bezeichnung der beiden Trinorbornan-Enatiomere ist (1Sa,4S,6R, 7S,9R)-Tetracyclo-[5.2.2.01,6.04,9]undecan und (1Ra,4S,6R, 7S,9R)-Tetracyclo-[5.2.2.01,6.04,9]undecan. Bei der Synthese der Verbindung erhält man ein Racemat.[1]
Einzelnachweise
- Lorenzo Delarue Bizzini, Thomas Müntener, Daniel Häussinger, Markus Neuburger, Marcel Mayor: Synthesis of trinorbornane. In: Chem. Commun. Band 53, Nr. 83, 2017, S. 11399, doi:10.1039/c7cc06273g (unibas.ch [PDF]).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Modification of the Parent Structure. Rule F-4.2. In: IUPAC Nomenclature of Organic Chemistry. Advanced Chemistry Development, abgerufen am 4. Dezember 2019.