Luche-Reduktion
Die Luche-Reduktion ist eine chemische Reaktion, die der selektiven Reduktion von Ketonen neben Aldehyden dient. Ihr Prinzip beruht auf der Aktivierung der Ketofunktion durch Lewis-Säuren. Sie ist benannt nach ihrem Entwickler Jean-Louis Luche.
Liegen in einem Molekül Aldehyd- und Ketofunktionen nebeneinander vor, so reduzieren harte Nukleophile bevorzugt die Aldehydfunktion. Dies liegt darin begründet, dass der aldehydische Kohlenstoff im Vergleich zum Carbonyl-Kohlenstoffatom des Ketons eine stärker positive Partialladung trägt und somit für einen Angriff harter Nukleophile bevorzugt ist. In einer Luche-Reduktion wird die Härte des ketonischen Kohlenstoffs durch die Komplexierung dessen Sauerstoffs durch Cer(III)-chlorid erhöht und somit diese Position zur Reduktion aktiviert.
Mechanismus
Im ersten Schritt koordiniert Cer(III)-chlorid an den ketonischen Sauerstoff. Das als Reduktionsmittel eingesetzte Natriumborhydrid hydriert nun diese Position bevorzugt. Der entstandene Alkohol wird zuletzt durch wässriger Aufarbeitung freigesetzt.
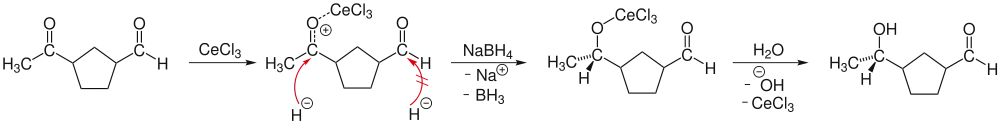
Die bevorzugte Reduktion der Ketofunktion wird noch durch einen zweiten Effekt verstärkt. Meist werden einfache Alkohole als Lösungsmittel verwendet, welche mit Natriumborhydrid zu verschiedenen Alkoxyborhydriden reagieren. Hierdurch erhöht sich die Härte des Reduktionsmittels und die Selektivität wird weiter zu Gunsten der Reduktion des aktivierten Ketons verschoben.[1]
Weitere Reaktionen
Die Luche-Bedingungen eignen sich auch zur Reduktion α,β-ungesättigter Ketone. In diesen Fällen ist auf Grund der Konjugation zur C=C-Doppelbindung der ketonische Kohlenstoff nicht hart genug, um von harten Nukleophilen angegriffen zu werden. Durch Aktivierung mit Cer(III)-chlorid wird wiederum dessen Härte erhöht und somit die Reduktion ermöglicht.
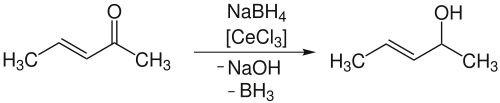
Unter Luche-Bedingungen können auch weitere harte Nukleophile, wie beispielsweise Grignard-Reagenzien oder Organolithium-Verbindungen eingesetzt werden. Diese reagieren mit der aktivierten Ketofunktion, ohne dass Enolisierung auftritt.[2]
Literatur
- R. Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Verlag, Heidelberg 2004, ISBN 3-8274-1579-9.
Einzelnachweise
- Andre L. Gemal, Jean Louis Luche: Lanthanoids in organic synthesis. 6. Reduction of α-enones by sodium borohydride in the presence of lanthanoid chlorides: synthetic and mechanistic aspects. In: Journal of the American Chemical Society. Band 103, Nr. 18, September 1981, S. 5454–5459, doi:10.1021/ja00408a029.
- Carl R. Johnson, Bradley D. Tait: A cerium(III) modification of the Peterson reaction: methylenation of readily enolizable carbonyl compounds. In: The Journal of Organic Chemistry. Band 52, Nr. 2, 1987, S. 281–283, doi:10.1021/jo00378a024.