Cobalt(III)-fluorid
Cobalt(III)-fluorid ist eine chemische Verbindung des Cobalts aus der Gruppe der Fluoride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
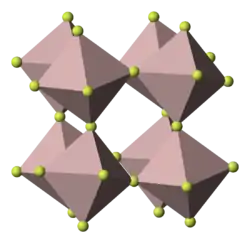 | ||||||||||||||||
| _ Co3+ _ F− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cobalt(III)-fluorid | |||||||||||||||
| Andere Namen |
Cobalttrifluorid | |||||||||||||||
| Verhältnisformel | CoF3 | |||||||||||||||
| Kurzbeschreibung |
hellbraunes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 115,93 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Cobalt(III)-fluorid kann durch Reaktion von Cobalt(II)-fluorid, Cobalt(II)-chlorid oder Cobalt(III)-oxid mit Fluor gewonnen werden.[1]
Eigenschaften
Cobalt(III)-fluorid ist ein hellbraunes Pulver, das sich an feuchter Luft sofort dunkelbraun färbt. Deshalb wird der Reinstoff luftdicht verschlossen in Gefäßen aus Glas, Quarz oder Metall aufbewahrt. In einem Fluorgasstrom bei 600–700 °C verflüchtigt es sich, wobei es vorher weitgehend in Cobalt(II)-fluorid und Fluor zerfällt. Mit Wasser reagiert es unter Sauerstoffentwicklung, wobei sich daneben auch Cobalt(III)-hydroxid bildet.[1] Es kommt auch als Dihydrat vor. Cobalt(III)-fluorid kristallisiert in einer Vanadium(III)-fluorid-Schichtstruktur.[5]
Verwendung
Cobalt(III)-fluorid kann zur Fluorierung organischer Verbindungen nach dem Fowler-Prozess verwendet werden.
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 276.
- Datenblatt Cobalt(III) fluoride bei Sigma-Aldrich, abgerufen am 25. Mai 2017 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-60.
- Webelements: Cobalt trifluoride
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1684.
