Tetrylene
Als Tetrylene werden die divalenten Verbindungen der Gruppe 14 (Tetrele) mit der allgemeinen Summenformel R2E (E = C, Si, Ge, Sn, Pb) bezeichnet. Die einzelnen Verbindungen dieser Stoffklasse sind die Carbene, Silylene, Germylene, Stannylene und Plumbylene. Das Zentralatom dieser Verbindungen trägt in der Regel die Oxidationsstufe +II. Sie können entsprechend ihrer Multiplizität in Singulett- und Tripletttetrylene eingeteilt werden, wobei letztere in der Regel nur bei den Carbenen von Relevanz sind.
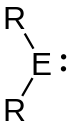
Struktur und Eigenschaften
Als zweibindige Gruppe 14-Verbindungen liegen alle Tetrylene gewinkelt vor. Da die Oktettregel bei Tetrylenen per Definition nicht erfüllt ist, verbleiben weiterhin zwei Elektronen am Zentralatom. Diese können sich entweder in einem Orbital befinden, wodurch das Tetrylen sich in einem Singulettzustand befindet. Dies ist insbesondere bei geringen Hybridisierungsgraden günstig, da sich die Elektronen dann in einem Orbital mit höherem s-Charakter befinden und s-Orbitale energetisch günstiger sind als die korrespondierenden p-Orbitale. Am Tetrylenzentrum befinden sich entsprechend ein freies Elektronenpaar und ein vakantes Orbital. Alternativ können sich die Elektronen auch in zwei verschiedenen Orbitalen aufhalten, das Tetrylen liegt dann entsprechend in einem Triplettzustand (als Diradikal) vor. Dies ist insbesondere bei hohen Hybridisierungsgraden günstig. Da die Hybridisierungstendenz im Allgemeinen mit steigender Periodizität abnimmt, sind Tripletttetrylene fast ausschließlich bei den Carbenen von praktischer Bedeutung (Schrock-Carbene).[1] Die Energiedifferenz zwischen dem Singulett- und dem Triplettzustand von Tetrylenen korrespondiert in vielen Fällen mit der Reaktivität. So erweisen sich Tetrylene mit kleinen Singulett-Triplett-Abständen beispielsweise als Vorteilhaft im Bezug auf die Aktivierung von H2[2][3] und anderen E–H-Bindungen (E = C, N, Si etc.).[3]
 Frontorbitale von Singuletttetrylenen
Frontorbitale von Singuletttetrylenen Frontorbitale von Tripletttetrylenen
Frontorbitale von Tripletttetrylenen
Tetrylene können sowohl kinetisch als auch thermodynamisch stabilisiert werden. Zur kinetischen Stabilisierung werden in der Regel sterisch anspruchsvolle Substituenten eingesetzt. Die kinetische Stabilisierung von Singuletttetrylenen erfolgt hingegen meist über dem Tetrylenzentrum benachbarte Atome, die ein freies Elektronenpaar tragen. Diese können Elektronendichte in das vakante Orbital am Gruppe 14-Element donieren. Das prominenteste Beispiel, in denen eine solche Stabilisierung eines Kohlenstoffatoms durch zwei Stickstoffatome erfolgt, sind die N-heterocyclischen Carbene. Allerdings gibt es auch Beispiele in denen die Stabilisierung durch Sauerstoff,[4] Phosphor,[5] Schwefel,[4] Halogene[6] oder ylidische Kohlenstoffatome[7][8] erfolgt.
Singuletttetrylene weisen durch ihr freies Elektronenpaar starke σ-Donoreigenschaften auf. Die Donorstärke hängt dabei eng mit der Energie des höchsten besetzten Molekülorbitals (HOMO) zusammen und nimmt bei gleicher Substitution mit steigender Ordnungszahl des Zentralatoms ab.[3] Gleichzeitig weisen Singuletttetrylene durch das vakante Orbital am Zentralatom starke π-Akzeptoreigenschaften auf. Diese hängen eng mit der Energie des niedrigsten unbesetzten Molekülorbitals (LUMO) zusammen und steigen mit zunehmender Ordnungszahl des Zentralatoms.[3] Die Donor- und Akzeptoreigenschaften können durch die Substituenten dabei deutlich beeinflusst werden. So führen -I-Effekte zu schwächeren σ-Donoren, +I-Effekte hingegen zu stärkeren.[3] Gleichzeitig sinkt die Akzeptorstärke mit einem zunehmenden +M-Effekt der Substituenten.[3] Auch der R–E–R-Bindungswinkel beeinflusst die Donorstärke der Tetrylene. So führen große Winkel durch eine damit verbundene Destabilisierung des HOMOs zu stärkeren Donoren.[9]
Synthese
Zur Synthese von Carbenen siehe dort. Die Synthese von schwereren Tetrylenen erfolgt in der Regel durch reduktive Dehalogenierung von geeigneten Precursoren. Auch die baseninduzierte Dehydrochlorierung, thermisch oder photochemisch Induzierte Reaktion sowie Transmetallierungen bieten sich hier an.[1]
Reaktivität und Anwendung
Dimerisierung
Unstabilisierte Tetrylene neigen zur Dimerisierung. Dabei bilden sich entsprechend die korrespondierenden Ditetrene (Alkene, Disilene, Digermene, Distannene und Diplumbene). Diese können sowohl klassische als auch nichtklassische Doppelbindungen aufweisen. Die klassischen Doppelbindungen resultieren dabei aus dem Überlapp der halb besetzten Molekülorbitale (SOMOs) zweier Tripletttetrylenfragmente, dadurch zur Ausbildung einer σ- und einer π-Bindung und damit einem planaren Molekül. Dies ist das gängige Auftreten von Alkenen. Die nichtklassischen Doppelbindungen resultieren aus der Wechselwirkung zweier Singulettetylene. Hierbei überlappt gegenseitig das freie Elektronenpaar eines Tetrylenfragments mit dem vakanten Orbital des anderen Tetrtylenfragments. Die Substituenten der Tetrylenfragmente sind in der Folge um etwa 45° aus der Ebene herausgedreht, es entsteht eine trans-bent-Struktur. Diese werden mit zunehmendem Singulett-Triplett-Abstand und damit mit zunehmender Ordnungszahl des Zentralatoms präferiert.[1]
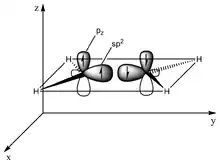 Überlapp zweier Tripletttetrylenfragmente
Überlapp zweier Tripletttetrylenfragmente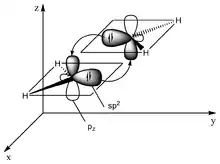 Überlapp zweier Singuletttetrylenfragmente
Überlapp zweier Singuletttetrylenfragmente
Einsatz als Liganden
Die wahrscheinlich wichtigste Anwendung von Tetrylenen, insbesondere von Carbenen,[10] findet sich als Ligand in Übergangsmetallkomplexen.[11][12][13]
Aktivierung von E–E-Bindungen
Ihre besondere elektronische Struktur macht Tetrylene interessant für die Aktivierung kleiner Moleküle wie H2. Eine solche Reaktion konnten erstmals Guy Bertrand und seine Mitarbeiter im Falle von cyclischen (Alkyl)(amino)carbenen nachweisen.[2] Sie führten die Reaktion auf einen Überlapp des freien Elektronenpaars am Carbenzentrum mit dem antibindenden σ*-Orbital des Wasserstoffs bei einer gleichzeitigen Interaktion des bindenden σ-Orbitals des Wasserstoffs mit dem vakanten Orbital am Kohlenstoffatom zurück.[2] Diese Reaktion ist mittlerweile auch für einige schwerere Tetrylene bekannt.[4][14] Neben der Aktivierung von Wasserstoff gibt es auch Beispiele in denen Tetrylene Ammoniak,[4][14] weißen Phosphor[4], Schwefel[15], C–H-[14][15], Si–H-[14] oder B–H-Bindungen[14] aktivieren.
Sonstige
Neben den beschriebenen zählen noch die Stabilisierung reaktiver Spezies,[10] die Organokatalyse[10] und der Einsatz in biologischen Studien[16] zu den Anwendungsgebieten von Tetrylenen. Außerdem reagieren sie in Cycloadditionsreaktionen.[1]
Verwandte Verbindungen
Es existieren weiterhin eine Reihe von zu Carbenen isolobale und isoelektronische Verbindungen. Diese werden erhalten, indem das zentrale Gruppe 14-Element formal durch ein einfach negativ geladenes Gruppe-13-Element (zum Beispiel B-,[17] Al-[18] oder Ga-[17]), ein einfach positiv geladenes Gruppe-15-Element (was zum Erhalt von Nitrenium-, Phosphenium-, Arsenium-, Stibenium- oder Bismutenium-Ionen führt) oder ein zweifach positiv geladenes Gruppe-16-Element (zum Beispiel S2+ oder Se2+) ausgetauscht wird.[1]
Einzelnachweise
- Erwin Riedel, Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser: Riedel, moderne anorganische Chemie. 4. Auflage. De Gruyter, Berlin 2012, ISBN 978-3-11-024900-2.
- G. D. Frey, V. Lavallo, B. Donnadieu, W. W. Schoeller, G. Bertrand: Facile Splitting of Hydrogen and Ammonia by Nucleophilic Activation at a Single Carbon Center. In: Science. Band 316, Nr. 5823, 20. April 2007, ISSN 0036-8075, S. 439–441, doi:10.1126/science.1141474.
- Bijoy Ghosh, Priyam Bharadwaz, Nibedita Sarkar, Ashwini K. Phukan: Activation of small molecules by cyclic alkyl amino silylenes (CAASis) and germylenes (CAAGes): a theoretical study. In: Dalton Transactions. Band 49, Nr. 39, 2020, ISSN 1477-9226, S. 13760–13772, doi:10.1039/D0DT03043K.
- Shiori Fujimori, Shigeyoshi Inoue: Small Molecule Activation by Two‐Coordinate Acyclic Silylenes. In: European Journal of Inorganic Chemistry. Band 2020, Nr. 33, 7. September 2020, ISSN 1434-1948, S. 3131–3142, doi:10.1002/ejic.202000479, PMID 32999589, PMC 7507849 (freier Volltext).
- Natalia Del Rio, Morelia Lopez‐Reyes, Antoine Baceiredo, Nathalie Saffon‐Merceron, Dennis Lutters: N,P‐Heterocyclic Germylene/B(C6F5)3 Adducts: A Lewis Pair with Multi‐reactive Sites. In: Angewandte Chemie International Edition. Band 56, Nr. 5, 24. Januar 2017, ISSN 1433-7851, S. 1365–1370, doi:10.1002/anie.201610455.
- Yoshiyuki Mizuhata, Takahiro Sasamori, Norihiro Tokitoh: Stable Heavier Carbene Analogues. In: Chemical Reviews. Band 109, Nr. 8, 12. August 2009, ISSN 0009-2665, S. 3479–3511, doi:10.1021/cr900093s.
- Isabel Alvarado-Beltran, Antoine Baceiredo, Nathalie Saffon-Merceron, Vicenç Branchadell, Tsuyoshi Kato: Cyclic Amino(Ylide) Silylene: A Stable Heterocyclic Silylene with Strongly Electron-Donating Character. In: Angewandte Chemie International Edition. Band 55, Nr. 52, 23. Dezember 2016, S. 16141–16144, doi:10.1002/anie.201609899.
- Matthew Asay, Shigeyoshi Inoue, Matthias Driess: Aromatic Ylide-Stabilized Carbocyclic Silylene. In: Angewandte Chemie International Edition. Band 50, Nr. 41, 4. Oktober 2011, S. 9589–9592, doi:10.1002/anie.201104805.
- Dominik Munz: Pushing Electrons—Which Carbene Ligand for Which Application? In: Organometallics. Band 37, Nr. 3, 12. Februar 2018, ISSN 0276-7333, S. 275–289, doi:10.1021/acs.organomet.7b00720.
- Matthew N. Hopkinson, Christian Richter, Michael Schedler, Frank Glorius: An overview of N-heterocyclic carbenes. In: Nature. Band 510, Nr. 7506, Juni 2014, ISSN 0028-0836, S. 485–49, doi:10.1038/nature13384.
- Javier A. Cabeza, Pablo García-Álvarez, Diego Polo: Intramolecularly Stabilized Heavier Tetrylenes: From Monodentate to Bidentate Ligands: Intramolecularly Stabilized Tetrylenes. In: European Journal of Inorganic Chemistry. Band 2016, Nr. 1, Januar 2016, S. 10–22, doi:10.1002/ejic.201500855.
- Mirjam J. Krahfuss, Udo Radius: N-Heterocyclic silylenes as ambiphilic activators and ligands. In: Dalton Transactions. Band 50, Nr. 20, 2021, ISSN 1477-9226, S. 6752–6765, doi:10.1039/D1DT00617G.
- Holger Braunschweig, Alexander Damme, Rian D. Dewhurst, Florian Hupp, J. Oscar C. Jimenez-Halla: σ-Donor–σ-acceptor plumbylene ligands: synergic σ-donation between ambiphilic Pt0 and Pbii fragments. In: Chemical Communications. Band 48, Nr. 84, 2012, ISSN 1359-7345, S. 10410, doi:10.1039/c2cc35777a.
- Matthew Usher, Andrey V. Protchenko, Arnab Rit, Jesús Campos, Eugene L. Kolychev: A Systematic Study of Structure and E-H Bond Activation Chemistry by Sterically Encumbered Germylene Complexes. In: Chemistry - A European Journal. Band 22, Nr. 33, 8. August 2016, S. 11685–11698, doi:10.1002/chem.201601840.
- Chandrajeet Mohapatra, Lennart T. Scharf, Thorsten Scherpf, Bert Mallick, Kai‐Stephan Feichtner, Viktoria H. Gessner: Isolation of a Diylide‐Stabilized Stannylene and Germylene: Enhanced Donor Strength through Coplanar Lone Pair Alignment. In: Angewandte Chemie International Edition. Band 58, Nr. 22, 27. Mai 2019, ISSN 1433-7851, S. 7459–7463, doi:10.1002/anie.201902831, PMID 30901140, PMC 6563488 (freier Volltext).
- Pritam Mahawar, Mishi Kaushal Wasson, Mahendra Kumar Sharma, Chandan Kumar Jha, Goutam Mukherjee: A Prelude to Biogermylene Chemistry. In: Angewandte Chemie International Edition. Band 59, Nr. 48, 23. November 2020, ISSN 1433-7851, S. 21377–21381, doi:10.1002/anie.202004551.
- Matthew Asay, Cameron Jones, Matthias Driess: N -Heterocyclic Carbene Analogues with Low-Valent Group 13 and Group 14 Elements: Syntheses, Structures, and Reactivities of a New Generation of Multitalented Ligands. In: Chemical Reviews. Band 111, Nr. 2, 9. Februar 2011, ISSN 0009-2665, S. 354–396, doi:10.1021/cr100216y.
- Jamie Hicks, Petra Vasko, Jose M. Goicoechea, Simon Aldridge: Synthesis, structure and reaction chemistry of a nucleophilic aluminyl anion. In: Nature. Band 557, Nr. 7703, Mai 2018, ISSN 0028-0836, S. 92–95, doi:10.1038/s41586-018-0037-y.