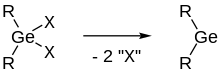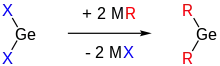Germylene
Germylene sind eine Klasse an germaniumorganischen Verbindungen und gehören zu den Tetrylenen. Als solche haben sie die allgemeine Summenformel R2Ge.
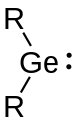
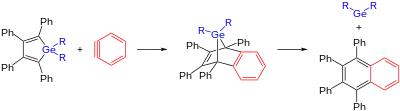
Darstellung
Germylene können auf verschiedene Arten hergestellt werden. Zum einen besteht die Möglichkeit des Umsetzens eines Germols mit einem Arin (zum Beispiel Dehydrobenzol). Dabei bildet sich zunächst ein Germabenzonorbornadien, welches sich unter thermischer Einwirkung zum korrespondierenden Germylen und Naphthalen zersetzt.[1]
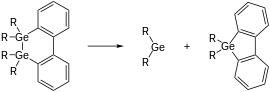
Eine weitere Möglichkeit zur Synthese von Germylenen ist die reduktive Dehalogenierung von Dihalogenierten Germanen.[1]
Weiterhin zersetzen sich viele Oligogermane photolytisch unter Abspaltung von Germylenen.[1]
Als vierte Möglichkeit besteht die Transmetallierung von Germaniumdichlorid mit Alkalimetallorganiylen.[2][3]
Struktur und Stabilität
Germylene sind niedervalente Verbindungen mit einem Divalenten Germaniumatom in der Oxidationsstufe +II. Entsprechend befinden sich noch zwei Elektronen am Germaniumatom, die keine Beiträge zu den Bindungen leisten. Da Germylene in der Regel im Singulettzustand vorliegen, bedeutet das, dass sich am Germaniumatom ein freies Elektronenpaar und ein vakantes p-Orbital befinden. Dadurch können Germylene sowohl als Elektronendonoren als auch als Elektronenakzeptoren fungieren.[4] Germylene sind bei gleicher Substitution schlechtere Donoren und bessere Akzeptoren als Silylene und gleichzeitig stärkere Donoren und schwächere Akzeptoren als Stannylene.[5]
 Das freie Elektronenpaar am Germanium
Das freie Elektronenpaar am Germanium Das vakante p-Orbital am Germanium
Das vakante p-Orbital am Germanium
Viele Parameter, mit denen sich die Reaktivität beschreiben lässt wie der Singulett-Triplett- oder der HOMO-LUMO-Abstand sind dabei stark von den Liganden und ihren elektronischen und sterischen Einflüssen abhängig.[5]
Reaktivität
Insbesondere nicht-stabilisierte Germylene und Germylene ohne sterische Abschirmung neigen zur Di- oder Oligomerisierung.[1] Die Dimere weisen dabei wie die meisten schweren Alkenhomologen nicht-klassische Doppelbindungen auf und liegen in einer trans-bent-Geometrie vor.[4]

Des Weiteren können Germylene [2+4]-Cycloadditionsreaktionen eingehen.[1]
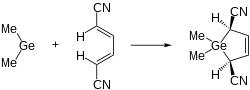
Außerdem sind Germylene dazu in der Lage, in diverse σ-Bindungen zu insertieren. Beispiele finden sich zum Beispiel für E–H- (E = H[6], B[6], C[1][6], N[1][6], O[1], Si[6], Ge[6]), C–X (X = Cl, Br)[1], C–E (E = N, O, S, Hg)[1] oder S–S-Bindungen.[2]
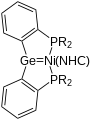
In ihrer Funktion als σ-Donor können sie auch als Donorliganden dienen.[7] Analog können sie auch durch ihr vakantes Orbital als σ-Akzeptoren fungieren.[1]
Einzelnachweise
- Wilhelm P. Neumann: Germylenes and stannylenes. In: Chemical Reviews. Band 91, Nr. 3, Mai 1991, ISSN 0009-2665, S. 311–334, doi:10.1021/cr00003a002.
- Chandrajeet Mohapatra, Lennart T. Scharf, Thorsten Scherpf, Bert Mallick, Kai‐Stephan Feichtner, Christopher Schwarz, Viktoria H. Gessner: Isolation of a Diylide‐Stabilized Stannylene and Germylene: Enhanced Donor Strength through Coplanar Lone Pair Alignment. In: Angewandte Chemie International Edition. Band 58, Nr. 22, 27. Mai 2019, ISSN 1433-7851, S. 7459–7463, doi:10.1002/anie.201902831, PMID 30901140, PMC 6563488 (freier Volltext).
- Chandrajeet Mohapatra, Heidar Darmandeh, Henning Steinert, Bert Mallick, Kai‐Stephan Feichtner, Viktoria H. Gessner: Synthesis of Low‐Valent Dinuclear Group 14 Compounds with Element–Element Bonds by Transylidation. In: Chemistry – A European Journal. Band 26, Nr. 66, 26. November 2020, ISSN 0947-6539, S. 15145–15149, doi:10.1002/chem.202004242, PMID 32954596, PMC 7756224 (freier Volltext).
- Erwin Riedel, Christoph Janiak, Hans-Jürgen Meyer: Riedel, moderne anorganische Chemie. 4. Auflage. De Gruyter, Berlin 2012, ISBN 978-3-11-024900-2.
- Henning Steinert, Julian Löffler, Viktoria H. Gessner: Single‐Site and Cooperative Bond Activation Reactions with Ylide‐Functionalized Tetrylenes: A Computational Study. In: European Journal of Inorganic Chemistry. 26. Oktober 2021, ISSN 1434-1948, S. ejic.202100816, doi:10.1002/ejic.202100816.
- Matthew Usher, Andrey V. Protchenko, Arnab Rit, Jesús Campos, Eugene L. Kolychev: A Systematic Study of Structure and E−H Bond Activation Chemistry by Sterically Encumbered Germylene Complexes. In: Chemistry – A European Journal. Band 22, Nr. 33, 2016, ISSN 1521-3765, S. 11685–11698, doi:10.1002/chem.201601840.
- Takahito Watanabe, Yumi Kasai, Hiromi Tobita: A Nickel Complex Containing a Pyramidalized, Ambiphilic Pincer Germylene Ligand. In: Chemistry – A European Journal. Band 25, Nr. 59, 22. Oktober 2019, ISSN 0947-6539, S. 13491–13495, doi:10.1002/chem.201903069.