Stannylene
Stannylene (R2Sn:) sind eine Klasse an zinnorganischen Verbindungen und gehören zu den Tetrylenen. Im Gegensatz zu Carbenen, die für gewöhnlich einen Triplettgrundzustand haben, haben Stannylene allerdings einen Singulettgrundzustand, da das Valenzorbital des Zinns eine geringere Tendenz zur Bildung von Hybridorbitalen aufweist und die 5s-Orbitale entsprechend gepaart sind.[1] Freie Stannylene werden durch sterische Abschirmung stabilisiert. Ebenso sind Addukte mit Lewisbasen bekannt.[2]
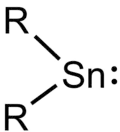
Synthese und Charakterisierung
Stabile Stannylene
Die meisten alkylsubstituierten Stannylene werden durch die Alkylierung von Zinn(II)-halogeniden mit lithiumorganischen Verbindungen synthetisiert. So wurde beispielsweise das erste stabile Stannylen [(Me3Si)2CH]2Sn 1973 von Michael Lappert durch die Umsetzung von (Me3Si)2CHLi mit Zinndichlorid erhalten.[3]
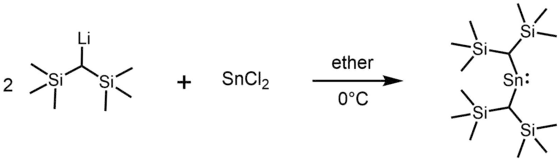
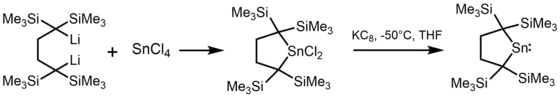
Lappert nutzte denselben Ansatz, um ein Jahr später das erste Diamidostannylen [(Me3Si)2N]2Sn zu synthetisieren.[4] In einigen Fällen war es auch möglich Stannylene durch die Reduktion einer Zinn(IV)-Verbindung mit KC8 herzustellen.[5]
Kurzlebige Stannylene
Die Isolierung von kurzlebigen Alkylstannylenen ist schwieriger. Die erste Isolierung von Dimethylstannylen erfolgte durch die Thermolyse des Cyclostannans (Me2Sn)6, das wiederum ein Produkt der Kondensation von Me2Sn(NEt2)2 und Me2SnH2 war. Der Nachweis erfolgte infrarotspektroskopisch durch den Vergleich mit berechneten Werten übereinstimmte.[6] Die Existenz wurde später weiterhin durch UV/VIS-Spektren, die mit SnMe2 in der Gasphase übereinstimmen, bestätigt.[7]
Eine andere Methode zur Synthese kurzlebiger Stannylene ist die Laserflashphotolyse von Tetraalkylzinn(IV)-Verbindungen als Edukten. Das entstehen der Stannylene kann durch entsprechende UV/VIS-Spektren beobachtet werden.[8]
Struktur und Bindung

Das Zinnatom kann als sp2-hybridisiert mit einem Vakanten 5p-Orbital und einem freien Elektronenpaar betrachtet werden. Das ist der Grund für die rote Farbe beim n-p-Übergang.[3][9]
Mit speziellen Liganden kann das Elektronendefizit von monomeren Stannylenen reduziert werden.So konnten Keith Izod et al. 2006 das cyclische Dialkylstannylen [{n-Pr2P(BH3)}(Me3Si)CCH2]2Sn synthetisieren. Die Molekülstruktur im Kristall wies dabei auf eine Ausrichtung einer B–H-Bindung zum Zinn hin. Dabei deutete der B–H··Sn-Abstand von 2,03 Å auf eine agostische Wechselwirkung hin. Die daraus resultierende Schwächung des Elektronendefizits am Zinn konnte weiterhin durch spektroskopische Daten nachgewiesen werden. Insbesondere im 119Sn-NMR-Spektrum konnte eine drastische Änderung der chemischen Verschiebung auf 587 und 787 ppm beobachtet werden, was auf eine höhere Elektronendichte am Zinn hindeutet. Analoge Dialkylstannylene weisen eine chemische Verschiebung von 2323 ppm auf.[10]
Reaktivität
Oligomerisierung

Kleine, instabile Stannylene (zum Beispiel Dimethylstannylen) oligomerisieren mit sich selbst zu cyclischen Organostannylenen, die als Stannylenquelle dienen können.[6]
Sterisch anspruchsvollere Stannylene (zum Beispiel Lapperts Stannylen) neigen im Gegensatz dazu zur Dimerisierung. Die Natur der Sn=Sn-Bindung in derartigen Distannylenen unterscheinden sich allerdings deutlich von den C=C-Bindungen in Carbendimeren (zum Beispiel in Alkenen). Während Alkene einen typischen Doppelbindungscharakter entwickeln und eine planare Geometrie aufweisen, haben Stannylene eine trans-bent-Geometrie. Das hängt damit zusammen, dass die Doppelbindung in Distannylenen als Summe von zwei Donor-Akzeptor-Wechselwirkungen aufgefasst werden. Eine Electron Localization Function (ELF) Analyse eines Stannylendimers zeigt dabei ein disynaptisches Becken (Elektronen in bindenden Orbitalen) ab beiden Zinnatomen. Das deutet darauf hin, dass die Wechselwirkung zwischen den beiden Zinnatomen als ungewöhnlich gebogene dative Bindungen aufgefasst werden kann.[11] Abseits davon ist die Stabilität von Stannylendimeren zusätzlich von sterischer Abstoßung und dispersiver Anziehung zwischen großen Substituenten abhängig.[12]
Insertionsreaktionen
Alkylstannylene können mit verschiedenen Reagenzien wie Halogenalkanen, Enonen und Dienen in einer oxidativen Addition oder Insertion reagieren.
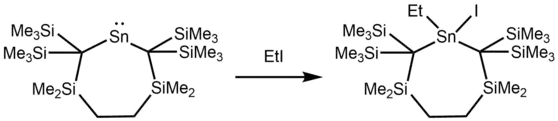
Die Reaktion eines Stannylens mit 9,10-Phenanthrolindion führt zu einem EPR-Signal, dass dem 9,10-Phenanthrendionradikalanion zugeordnet werden kann. Das deutet darauf hin, dass die Reaktion über einen radikalischen Mechanismus abläuft.[13]
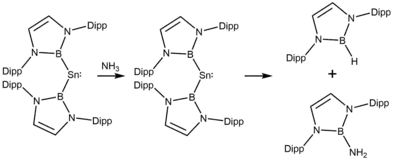
Im Bezug auf das SnII/SnIV-Paar ähneln verschiedene Stannylene Übergangsmetallen. So gilt das Verhalten in Oxidativen Additionen als stark vom Singulet-Triplet-Abstand abhängig.[14] So führt die Funktionalisierung mit als sehr starke σ-Donoren bekannten Borylsubstituenten zu Verbindungen, die nicht nur molekularen Wasserstoff, sondern auch verschiedene E–H-Bindungen (E = B, O, N, Si) spalten können. Im Fall von Ammoniak und Wasser kann das Reaktionsprodukt auch eine reduktive Eliminierung eingehen und zur Bildung von O–B- oder N–B-Bindungen führen.[15]
Cycloadditionen
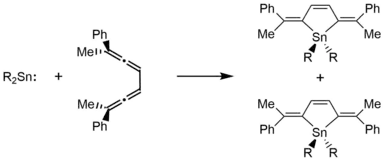
Obwohl Stannylene stabiler sind als ihre leichteren Carbenanaloga, gehen sie [2+4]-Cycloadditionsreaktionen ein, die zu Z-Alkenen führen. So reagiert (CH(SiMe3)2)2Sn mit 2,7-Diphenylocta-2,3,5,6-tetraen chelotrop und entsprechend der Woodward-Hoffmann-Regeln.[16]
Einzelnachweise
- T. Sasamori, N. Tokitoh: Encyclopedia of Inorganic Chemistry II. John Wiley & Sons, Chichester, U.K. 2005, S. 1698–1740.
- Yoshiyuki Mizuhata, Takahiro Sasamori, Norihiro Tokitoh: Stable Heavier Carbene Analogues. In: Chemical Reviews. Band 109, Nr. 8, 12. August 2009, S. 3479–3511, doi:10.1021/cr900093s.
- Peter J. Davidson, Michael F. Lappert: Stabilisation of metals in a low co-ordinative environment using the bis(trimethylsilyl)methyl ligand; coloured Sn II and Pb II alkyls, M[CH(SiMe3)2]2. In: Journal of the Chemical Society, Chemical Communications. Nr. 9, 1973, S. 317a, doi:10.1039/c3973000317a.
- David H. Harris, Michael F. Lappert: Monomeric, volatile bivalent amides of group IV B elements, M(NR12)2 and M(NR1R2)2 (M=Ge, Sn, or Pb; R1=Me3Si, R2=Me3C). In: J. Chem. Soc., Chem. Commun. Nr. 21, 1974, S. 895–896, doi:10.1039/C39740000895.
- Mitsuo Kira, Shintaro Ishida, Takeaki Iwamoto, Rika Yauchibara, Hideki Sakurai: New synthesis of a stable dialkylstannylene and its reversible complexation with tetrahydrofuran. In: Journal of Organometallic Chemistry. Band 636, Nr. 1-2, November 2001, S. 144–147, doi:10.1016/S0022-328X(01)00998-6.
- Paul Bleckmann, Hartwig Maly, Rolf Minkwitz, Wilhelm P. Neumann, Bärbel Watta: Matrix Isolation and IR spectroscopy of stannylenes (CH3)2Sn and (CD3)2Sn. In: Tetrahedron Letters. Band 23, Nr. 45, 1982, S. 4655–4658, doi:10.1016/S0040-4039(00)85679-8.
- Rosa Becerra, Sergey E. Boganov, Mikhail P. Egorov, Valery I. Faustov, Irina V. Krylova: First Gas-Phase Detection of Dimethylstannylene and Time-Resolved Study of Some of Its Reactions. In: Journal of the American Chemical Society. Band 124, Nr. 25, 1. Juni 2002, S. 7555–7562, doi:10.1021/ja012691k.
- Rosa Becerra, Peter P. Gaspar, Cameron R. Harrington, William J. Leigh, Ignacio Vargas-Baca: Direct Detection of Dimethylstannylene and Tetramethyldistannene in Solution and the Gas Phase by Laser Flash Photolysis of 1,1-Dimethylstannacyclopent-3-enes. In: Journal of the American Chemical Society. Band 127, Nr. 49, Dezember 2005, S. 17469–17478, doi:10.1021/ja052675d.
- Alwyn George Davies: Organotin chemistry. 2nd, completely rev. and updated ed Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31023-1.
- Keith Izod, William McFarlane, Brent V. Tyson, Ian Carr, William Clegg: Stabilization of a Dialkylstannylene by Unusual B−H···Sn γ-Agostic-Type Interactions. A Structural, Spectroscopic, and DFT Study. In: Organometallics. Band 25, Nr. 5, Februar 2006, S. 1135–1143, doi:10.1021/om0600036.
- Nathaniel O. J. Malcolm, Ronald J. Gillespie, Paul L. A. Popelier: A topological study of homonuclear multiple bonds between the elements of group 14. In: Journal of the Chemical Society, Dalton Transactions. Nr. 17, 29. August 2002, S. 3333–3341, doi:10.1039/b110610b.
- Robert Sedlak, Olga A. Stasyuk, Célia Fonseca Guerra, Jan Řezáč, Aleš Růžička: New Insight into the Nature of Bonding in the Dimers of Lappert’s Stannylene and Its Ge Analogs: A Quantum Mechanical Study. In: Journal of Chemical Theory and Computation. Band 12, Nr. 4, 12. April 2016, S. 1696–1704, doi:10.1021/acs.jctc.6b00065.
- Ashrafolmolouk Asadi, Colin Eaborn, Michael S. Hill, Peter B. Hitchcock, Margaret M. Meehan: Reactions of a Highly Crowded Cyclic Stannylene with Iodoalkanes, Enones, and Dienes. Inhibition of Nucleophilic Substitution at Tin(IV) Centers. In: Organometallics. Band 21, Nr. 12, Juni 2002, S. 2430–2437, doi:10.1021/om020106y.
- Yong Wang, Jing Ma: Silylenes and germylenes: The activation of H–H bond in hydrogen molecule. In: Journal of Organometallic Chemistry. Band 694, Nr. 16, Juli 2009, S. 2567–2575, doi:10.1016/j.jorganchem.2009.03.051.
- Andrey V. Protchenko, Joshua I. Bates, Liban M. A. Saleh, Matthew P. Blake, Andrew D. Schwarz: Enabling and Probing Oxidative Addition and Reductive Elimination at a Group 14 Metal Center: Cleavage and Functionalization of E–H Bonds by a Bis(boryl)stannylene. In: Journal of the American Chemical Society. Band 138, Nr. 13, 6. April 2016, S. 4555–4564, doi:10.1021/jacs.6b00710.
- Rainer Marx, Wilhelm P. Neumann, Knut Hillner: [2+4] Cheletropic cycloadditions of stannylenes R2Sn (R = alkyl, amino, halogen). In: Tetrahedron Letters. Band 25, Nr. 6, Januar 1984, S. 625–628, doi:10.1016/S0040-4039(00)99955-6.