Cyclische (Alkyl)(amino)carbene
Bei cyclischen (Alkyl)(amino)carbenen (CAACs) handelt es sich um Carbene, die in einer cyclischen Struktur von nur einem Stickstoffatom benachbart sind.[1] Sie sind mit den N-heterocyclischen Carbenen (NHCs) verwandt, die zwei benachbarte Stickstoffatome besitzen. Im Gegensatz zu diesen handelt es sich bei CAACs allerdings um stärkere π-Akzeptoren und σ-Donorliganden.[2]
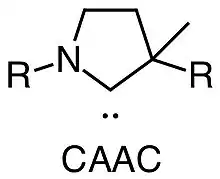
CAACs spielen vor allem als Liganden in metallorganischen Verbindungen eine Rolle.[3][4]
Darstellung
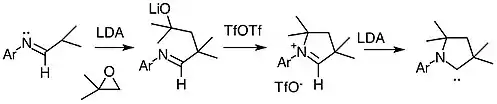
Die Darstellung vieler CAACs folgt der ursprünglich von Guy Bertrand und seinen Mitarbeitern beschriebenen Route. Diese beginnt mit der Kondensation von 2,6-Diisopropylanilin mit Isobutanal. Die Deprotonierung des entstehenden Aldimins mit Lithiumdiisopropylamid (LDA) führt zu einem Azaallylanion, das zu einer Ringöffnung von 1,2-Epoxy-2-methylpropan führt. Das resultierende Lithiumalkoholat wird in der Folge mit Trifluormethansulfonsäureanhydrid umgesetzt, was zum Aldiminiumsalz führt. Dieses wird in einem letzten Schritt mittels LDA deprotoniert, wodurch das Carben als farbloser Feststoff entsteht.[1] Später wurde die Syntheseroute weiter optimiert.[5]
Reaktivität
2007 konnte die Arbeitsgruppe von Guy Bertrand mittels mehrerer CAACs nukleophil Wasserstoff spalten, was bei NHCs nicht möglich ist.[6] Dies wird auf ein energetisch etwas höher liegendes höchstes besetztes Molekülorbital (HOMO) sowie einen geringeren Singlet-Triplet-Abstand zurückgeführt.[6] Das führt bei dieser Reaktion zu einer deutlich geringeren Aktivierungsenergie von etwa 100 kJ/mol gegenüber NHCs (etwa 150 kJ/mol).[6]
Siehe auch
Einzelnachweise
- Vincent Lavallo, Yves Canac, Carsten Präsang, Bruno Donnadieu, Guy Bertrand: Stable Cyclic (Alkyl)(Amino)Carbenes as Rigid or Flexible, Bulky, Electron-Rich Ligands for Transition-Metal Catalysts: A Quaternary Carbon Atom Makes the Difference. In: Angewandte Chemie International Edition. Band 44, Nr. 35, 5. September 2005, S. 5705–5709, doi:10.1002/anie.200501841, PMID 16059961, PMC 2427276 (freier Volltext).
- Research Highlights. Abgerufen am 8. November 2019 (englisch).
- Erik A. Romero, Rodolphe Jazzar, Guy Bertrand: (CAAC)CuX-catalyzed hydroboration of terminal alkynes with pinacolborane directed by the X-ligand. In: Journal of Organometallic Chemistry. Band 829, Februar 2017, S. 11–13, doi:10.1016/j.jorganchem.2016.09.025.
- Eder Tomás-Mendivil, Max M. Hansmann, Cory M. Weinstein, Rodolphe Jazzar, Mohand Melaimi: Bicyclic (Alkyl)(amino)carbenes (BICAACs): Stable Carbenes More Ambiphilic than CAACs. In: Journal of the American Chemical Society. Band 139, Nr. 23, 14. Juni 2017, S. 7753–7756, doi:10.1021/jacs.7b04640.
- Carsten Müller, Diego M. Andrada, Inga-Alexandra Bischoff, Michael Zimmer, Volker Huch: Synthesis, Structure, and Bonding Analysis of Tin(II) Dihalide and Cyclopentadienyltin(II) Halide (Alkyl)(amino)carbene Complexes. In: Organometallics. Band 38, Nr. 5, 11. März 2019, ISSN 0276-7333, S. 1052–1061, doi:10.1021/acs.organomet.8b00861 (acs.org [abgerufen am 2. September 2020]).
- G. D. Frey, V. Lavallo, B. Donnadieu, W. W. Schoeller, G. Bertrand: Facile Splitting of Hydrogen and Ammonia by Nucleophilic Activation at a Single Carbon Center. In: Science. Band 316, Nr. 5823, 20. April 2007, S. 439–441, doi:10.1126/science.1141474.