Sumpfohreule
Die Sumpfohreule (Asio flammeus) ist eine Vogelart aus der Gattung der Ohreulen (Asio) innerhalb der Familie der Eigentlichen Eulen (Strigidae). Ihre kurzen Federohren sind meist angelegt und somit nicht sichtbar. Der englische Name Short Eared Owl betont dieses Merkmal, während der deutsche die Lebensraumpräferenzen der Art für Feucht- und Marschgebiete unterstreicht.
| Sumpfohreule | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

Sumpfohreule (Asio flammeus) | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Asio flammeus | ||||||||||
| (Pontoppidan, 1763) |
Der mit etwa 40 Zentimeter Körperlänge knapp krähengroße Vogel kommt in zumindest sieben Unterarten beinahe weltweit vor und zählt damit zu den Eulenarten mit dem größten Verbreitungsgebiet. Sumpfohreulen gehören zu den wenigen Arten der Strigidae, denen es gelang, auch küstenferne Inseln zu besiedeln. Auf Hawaii ist sie die einzige Eulenart.
Die zum Teil auch tagaktive, meist bodenbrütende Eule ernährt sich vor allem von kleinen Säugetieren, insbesondere von Wühlmäusen. In vielen Gebieten sind ihre Bestände in den letzten Jahrzehnten stark zurückgegangen. In Mitteleuropa ist sie ein seltener Brutvogel mit weiträumig zerstreutem Brutvorkommen. Sumpfohreulen führen ein weitgehend vagabundierendes, wenig ortsgebundenes Leben, die nördlicheren Populationen sind Zugvögel mit Zugstrecken von mehreren Tausend Kilometern.
Merkmale
Aussehen

_-_Spiekeroog%252C_Nationalpark_nieders%C3%A4chsisches_Wattenmeer.jpg.webp)
Die Gefiederfärbung der Sumpfohreule ist recht variabel. Typisch sind stroh- oder fahl schilfbraune Grundfärbungen, es kommen auch Exemplare in warmen Brauntönen und graue Individuen mit sehr heller, fast weißer Unterseite und Beinbefiederung vor. Charakteristisch für die Art sind die schwarz umrandeten Augen mit der schwefelgelben Iris, der runde Kopf meist ohne sichtbare Federohren sowie die deutliche Längsstrichelung der Bauchseite.
Eine typisch gefärbte Sumpfohreule der Nominatform ist auf der Oberseite auf schilfgelbem oder strohfarbenem Untergrund unregelmäßig und grob rötlichbraun geflockt. In dieses Muster sind tropfenförmige weiße Markierungen eingelassen, die am Rücken und der Schulter deutlich sein können. Die Armdecken sind dunkler und oft ungezeichnet. Die Handschwingen sind ähnlich wie die Oberseite gefärbt und deutlich, meist dreifach dunkelbraun gebändert. Diese Bänderung setzt sich auf den Armschwingen fort, die an den Basen deutlich heller sind und oft einen hell rötlichbraunen, manchmal orangebraunen Farbton aufweisen; dieses Merkmal und die dunklen Armdecken sind auch beim sitzenden Vogel auffällig. Der gerade abgeschnittene, mehrfach dunkelbraun gebänderte Schwanz ist rötlichbraun. Die Schwingen und die Steuerfedern sind auf der Oberseite recht auffällig weiß gerandet, die Außenfahnen der äußeren Steuerfedern sind weiß. Nacken und Kopf sind rötlichbraun und unregelmäßig dunkelbraun gestrichelt. Die kurzen, eng beieinander liegenden Federohren sind meist überhaupt nicht oder nur als kleine Stummel wahrnehmbar. Bei Erregung voll aufgerichtet ragen sie weniger als einen Zentimeter aus dem Kopfgefieder hervor.[1] Die Unterseite ist insgesamt heller gelblich-rahmfarben, in der Kehlregion am dunkelsten und wird zum Steiß hin heller. Sie ist deutlich dunkelbraun längsgestrichelt, Querzeichnungen wie bei der Waldohreule fehlen. Die Beine und die Zehen sind im Grundton der Unterseite dicht befiedert. Die Krallen sind dunkel hornfarben. Schwingen und Schwanz sind auf der Unterseite sehr hell und besonders an den Spitzen der Handschwingen auffällig quergebändert. Markant ist ein dunkler, halbmondförmiger Handwurzelfleck. Der Gesichtsschleier ist breit herzförmig, dunkel-hell gerandet und auf hellem, zum Rand hin etwas dunklerem Grund dunkel strahlig gezeichnet. Besonders bei älteren Vögeln ist die untere Umrandung oft rein weiß. Die Augen sind von einer auffälligen und arttypischen schwarzen Maske umgeben, die Iris ist gelb. Ein borstenartiger, heller Federsaum fasst die Augen und den Schnabel zum Teil ein und bildet eine markante X-Zeichnung.
Die Geschlechter unterscheiden sich in der Färbung nicht; das erste Adultkleid gleicht bereits weitgehend dem Jahreskleid dieser Art.
Charakteristisch für das Flugbild der Art sind die langen schlanken Flügel mit der hellen, oft bis auf die Spitzen annähernd zeichnungslosen Unterseite. Sumpfohreulen fliegen mit kräftigen, tief durchgezogenen Flügelschlägen, gleiten weihenartig in leichter V-Stellung und rütteln oft.
Biometrische Daten
Sumpfohreulen entsprechen in der Größe weitgehend der Waldohreule, sind aber kompakter und wesentlich schwerer als diese. Der reverse Geschlechtsdimorphismus ist in Hinblick auf das Gewicht moderat ausgeprägt, in Bezug auf die Größe unauffällig. Die Weibchen sind schwerer und wiegen im Durchschnitt 420 Gramm, die Männchen 350 Gramm. Gewichte unter 280 Gramm gelten für die Nominatform als Hungergewichte.[2] Die Körperlänge erwachsener Eulen reicht von 34 bis 42 Zentimeter, die Flügelspannweite liegt zwischen 97 und 107 Zentimetern, wobei die höchsten Werte wieder auf Weibchen entfallen.[3]
Gewicht und Größe variieren zwischen den verschiedenen Unterarten recht erheblich: Individuen der Nominatform und der im südlichen Südamerika beheimateten Unterart A. f. suinda sind die größten und schwersten, jene der Inselform A. f. ponapensis von den Karolinen die kleinsten und leichtesten.[4]
Akustische Äußerungen
Sumpfohreulen verfügen über eine Reihe von Lauten, Rufen und Instrumentallauten. Der Revierruf des Männchens ist ein hohles, nicht sehr lautes, bis zu 20-mal gereihtes „Hu“ oder „Bu“. Die in der Tonhöhe leicht ansteigende Ruffolge erinnert etwas an die Rufe des Wiedehopfs. Der Ruf wird sowohl im Fliegen als auch sitzend vorgetragen. Die Rufe der Weibchen haben einen fauchenden, zischenden Charakter und lassen sich nur schwer transkribieren. In Konfliktsituationen und bei Beunruhigung ist ein miauendes, langgezogenes „Kiiijá“ zu hören, bei dem die zweite Silbe deutlich betont ist.
Eindrucksvoll ist das Flügelklatschen dieser Eulenart, das sowohl während der Balz in Sturzflügen als auch bei Auseinandersetzungen mit Rivalen eingesetzt wird. Das Zusammenschlagen der Flügel in rascher Abfolge erzeugt ein knatterndes, an Fahnenknattern erinnerndes Geräusch.[5] Wie andere Eulen fauchen Sumpfohreulen in Konflikt- oder Abwehrsituationen oder knappen mit dem Schnabel.
- Beunruhigte Sumpfohreule (MP3-Datei; 747 kB)
- Revierruf (MP3-Datei; 57 kB)
Mauser
Ab dem fünften Lebenstag wachsen die Mesoptilfedern in die Eidunen ein. Das Wachstum des Großgefieders beginnt um den 10. Lebenstag. In der Jugendmauser, die schon nach 25–28 Tagen einsetzt, werden das Mesoptilgefieder weitgehend und zudem große Teile der Armdecken ersetzt. Diese Mauser ist nach etwa 30 Tagen abgeschlossen. Die immature, etwa 2 Monate alte Eule ist in ihrem ersten Adultkleid nur mehr schwer von Eulen im Alterskleid zu unterscheiden. Manchmal bleiben Mesoptilreste im Bauchbereich länger stehen und ermöglichen auch feldornithologisch eine Altersbestimmung.[6] Die Jahresmauser adulter Vögel beginnt mit dem Großgefieder bei den Weibchen oft schon während der Brut. Dabei werden, beginnend mit der ersten Handschwinge, die Schwingen und die Steuerfedern zur Gänze gewechselt. Der Wechsel des Kleingefieders setzt etwas später ein und ist im Spätsommer oder Frühherbst beendet.[6][7]
Ähnliche Arten
Bei ausreichenden Beobachtungsbedingungen ist die Sumpfohreule immer bestimmbar, Verwechslungen könnten bei fliegenden Vögeln aber vorkommen. Eine Geschlechtsbestimmung ist feldornithologisch ohne situativen Bezug nicht möglich.
Für Verwechslungen kommen die Waldohreule und die Schreieule (Asio clamator) in Frage. Beide Eulen haben markante, immer sichtbare Federohren. Die Waldohreule ist schlanker, der Gesichtsschleier ist schmaler, die Augen sind dunkelorange. Die Unterseite ist nicht nur längsgestrichelt, sondern auch leicht quergezeichnet. Ihre Flügel sind kürzer und runder und auf der Unterseite dunkler und meist deutlicher gebändert. Der Schwanz weist zahlreichere und schmalere Binden auf als der der Sumpfohreule.
Die Schreieule unterscheidet sich abgesehen von den arttypischen Lautäußerungen vor allem durch den breiten, schwarz gerandeten Gesichtsschleier und die etwas geringere Größe.[8]
Verbreitungsgebiet
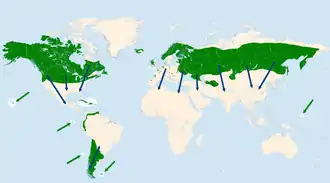
Das Verbreitungsgebiet der Sumpfohreule ist sehr groß, es wird unter den Eulen nur von dem der Schleiereule übertroffen. In den meisten Gebieten ist die Art nicht flächendeckend vertreten, sondern kommt nur zerstreut, dem jeweiligen Nahrungsangebot folgend, vor, sodass die Brutdichte dieser Art sehr großen Schwankungen unterworfen ist. In einer groß angelegten finnischen Untersuchung wurden von 1986 bis 2004 zwischen einem und 132 beflogenen Nestern festgestellt; 2005 erhöhte sich diese Zahl auf 304 Nester, um im Jahr darauf wieder auf einen Stand von 55 Nestern zu fallen.[9]
In der Nearktis besiedelt die Art Nordamerika südwärts etwa bis zum 35. Breitengrad. Die nördlichsten Brutgebiete liegen auf Banks Island und Victoria Island. 4000 Kilometer von den Festlandvorkommen entfernt, brüten Sumpfohreulen auf einigen der Hawaii-Inseln. Ein weiteres Vorkommen im Pazifik ist von Pohnpei, einer Insel der Karolinen, und einigen Marianeninseln bekannt. In der Karibik ist die Sumpfohreule Brutvogel aller großen Antilleninseln und einiger der Kleinen Antillen. In Südamerika liegen die dichtesten Vorkommen in der Südhälfte des Kontinents und reichen dort bis Feuerland; zerstreut und selten brütet sie im nördlichen Teil sowie in den Andenregionen. Die Sumpfohreule ist darüber hinaus Brutvogel der Falklandinseln und der Juan-Fernández-Inseln. Die lange als Unterart geltenden Ohreulen der Galapagosinseln wurden als eigenständige Art, Galápagos-Ohreule (Asio galapagoensis), abgetrennt.[10]
In der Paläarktis liegen die westlichsten Brutvorkommen auf Island, wo sie neben der nur fallweise brütenden Schneeeule die einzige Eulenart ist. Sie kommt sehr zerstreut in Großbritannien vor, in Irland wird sie häufig nachgewiesen, Bruten wurden bisher nicht bestätigt.[11] Sehr zerstreut und in der Dichte stark fluktuierend brüten Sumpfohreulen in West-, Südwest- und Mitteleuropa. Ob Brutvorkommen in den südlichen Balkanstaaten und in der Türkei bestehen, ist unsicher. Das weitgehend geschlossene paläarktische Verbreitungsgebiet umfasst weite Teile Skandinaviens, das Baltikum, Belarus sowie die Ukraine und erstreckt sich ostwärts in einem breiten Gürtel bis an die Pazifikküste. Die Nordgrenze der paläarktischen Verbreitung liegt bei 70° Nord, die uneinheitliche Südgrenze schwankt um den 50. Breitengrad. Die südlichsten Vorkommen gibt es in den zentralasiatischen Steppen zwischen Kaspischem Meer und Aralsee.
In Deutschland sind außer den Brutgebieten in Norddeutschland und auf einigen der friesischen Inseln, insbesondere auf Borkum, einige – jedoch nur temporär besetzte – Brutplätze südwärts bis zum nördlichen Alpenrand bekannt. Im süddeutschen Raum brütete die Art im schwäbischen Donaumoos bei Ulm am häufigsten, zuletzt 1979.[12] In Bayern gilt sie als sehr seltener, unregelmäßiger Brutgast. Nach 19 Jahren ohne Brutnachweis konnten im starken Mäusejahr 2005 drei erfolgreich brütende Paare im Nördlinger Ries nachgewiesen werden.[13] In Sachsen-Anhalt wurde z. B. 2015 im Fiener Bruch eine Brut beobachtet.
In Österreich ist in guten Wühlmausjahren die Sumpfohreule im Seewinkel des Neusiedlersees Brutvogel mit bis zu 20 Brutpaaren, brütet aber auch dort nicht regelmäßig. Die Vorkommen im Rheindelta in Vorarlberg sind erloschen. Aus der Schweiz liegen weder historische noch aktuelle Brutnachweise vor.
Wanderungen
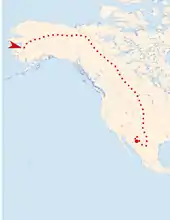
Die Sumpfohreule ist ähnlich wie die Sperbereule eine sehr vagile, wenig ortsgebundene Eulenart. Nur die Inselpopulationen sind naturgemäß weitgehend ortstreu. Vor allem Jungvögel streichen nach dem Selbständigwerden sehr weit umher. Eine 1961 auf Borkum nestjung beringte Eule wurde im November desselben Jahres in Portugal erlegt; sie hatte nach dem Ausfliegen eine Distanz von über 2000 Kilometern zurückgelegt.[15] Alle Brutvögel aus den nördlichen Brutgebieten verstreichen im Winter in südliche Gebiete, skandinavische und mitteleuropäische Brutvögel auch in westliche Richtungen an die Atlantikküste oder nach England. Wanderungen über mehrere tausend Kilometer sind keine Seltenheit. Eulen, die südlich des 50. Breitengrades brüten, scheinen häufig Standvögel zu sein oder nur ein kleinräumig nomadisches Leben zu führen.[16] Winterquartiere paläarktischer Vögel liegen im Mittelmeerraum, manche ziehen bis in die Sahelzone südlich der Sahara. Osteuropäische und asiatische Sumpfohreulen überwintern häufig im Schwarzmeerraum und den Steppengebieten Zentralasiens. Sie gelangen im Winter bis nach Südindien, Südchina, Taiwan und Japan. Die hochnordischen nearktischen Populationen wandern im Winter nach Süden. In dieser Jahreszeit kann die Art in geeigneten Habitaten in den gesamten südlichen USA und in Nordmexiko angetroffen werden. Einige Populationen aus dem südlichen Patagonien führen eine Nordwanderung durch. Die Art wurde auf Grönland, auf Madeira und auf den Azoren nachgewiesen.[17] Gelegentlich landen Sumpfohreulen weitab von der nächsten Küste auf Schiffen.[16]
Sumpfohreulen verlassen sehr bald nach dem Ausfliegen der Jungvögel das Brutgebiet. Der eigentliche zielgerichtete Zug beginnt jedoch erst im September und erreicht im Oktober seinen Höhepunkt. Die Art streift im Winterquartier weiträumig umher. In Gebieten mit besonders ergiebigem Nahrungsangebot können sich zeitweise große Gesellschaften von in Ausnahmefällen bis zu 200 Individuen aufhalten und bilden dann, wie die Waldohreule, größere Schlafgemeinschaften.[18]
Es kommt in Mitteleuropa zu Einflügen mit anschließenden Bruten weit ab von regelmäßigen Brutplätzen, wenn zwei Bedingungen gleichzeitig erfüllt sind: Es müssen in den normalen Brutgebieten in Norden und Osten Europas schwache Nagerpopulationen vorhanden sein bei gleichzeitigem Massenvorkommen von Feldmaus und/oder Erdmäusen im mitteleuropäischen Binnenland.[19]
Lebensraum

Sumpfohreulen benötigen offene, weitgehend baumlose Landschaften mit teilweise niedriger Vegetation, die mosaikartig mit Strauch-, Seggen- oder Röhrichtabschnitten durchsetzt sind und der Art damit Deckung und die notwendigen Brutplätze bieten. Sie ist nicht notwendigerweise auf Feuchtbiotope angewiesen, doch findet sie vor allem in Mitteleuropa geeignete Habitatstrukturen vor allem in solchen. Sie ähnelt in ihren Lebensraumansprüchen stark verschiedenen Weihenarten, vor allem der Korn- und der Wiesenweihe.
Sumpfohreulen brüten vor allem in der Tundra, in schütter baumbestandenen Heiden und Mooren, in Verlandungszonen, Dünengebieten und küstennahen Salzwiesen. Sie können in extensiv genutztem Agrarland, wie auf nassen Weiden, insbesondere Hutweiden, auf Agrarbrachen, in sehr lichten Wäldern und Aufforstungen sowie auf großen Kahlschlägen inmitten zusammenhängender Waldgebiete vorkommen. Beobachtet wurden Bruten sowohl in Getreidefeldern als auch auf Kuba in Zuckerrohrplantagen.[20] In der Nearktis brütet die Sumpfohreule in der Tundraregion, im Süden vor allem in den Grassteppen der Great Plains und in der Neotropis in den „Pampas“ Patagoniens. In der Andenregion steigt sie bis in die Gebirgssteppen des Páramo auf und erreicht dort in einer Höhe von etwa 4000 Metern ihre höchsten Brutplätze.[4] Die wenigen binnenländischen Brutgebiete liegen fast ausnahmslos in Feuchtgebieten, oft in abgetorften, mit Seggen bewachsenen Moorflächen.[21]
Siedlungsdichte
In guten Wühlmausjahren können Sumpfohreulen in geringem Abstand zueinander brüten, beanspruchen aber getrennte Territorien. Im Donaumoos brüteten 1967 16 Paare; die Reviergrößen betrugen zwischen 9 und 22 Hektar.[22] In Alaska wurden Territorien mit durchschnittlichen Größen von 20 Hektar festgestellt, in Schottland von 45 Hektar.[23] Generell hängt die Reviergröße von der allgemeinen Nahrungsverfügbarkeit und der Güte des Jagdgebietes ab.[24] Die Jagdgebiete liegen oft außerhalb der Reviere, gelegentlich bis zu zwei Kilometer von diesen entfernt.

Nahrung und Nahrungserwerb
Nahrung
Sumpfohreulen ernähren sich und ihre Nestlinge vor allem von kleinen Säugetieren, insbesondere von Wühlmäusen. Unter diesen ist in der Westpaläarktis die Feldmaus (Microtus arvalis) das mit Abstand wichtigste Beutetier. Andere Wühlmausarten, wie die Erdmaus (Microtus agrestis) und verschiedene Arten der Lemminge werden ebenfalls häufig erbeutet. In der Ostpaläarktis und in Nordamerika dominieren ebenfalls Microtus-Arten im Nahrungsspektrum, in der Nearktis die Wiesenwühlmaus (Microtus pennsylvanicus) neben Lemmingen. Vor allem bei hoher Schneelage kann die Hirschmaus (Peromyscus maniculatus), die auch im Winter an der Oberfläche lebt und nicht unter der Schneedecke (subnival) wie die Wühlmausarten, ein wichtiger Nahrungsbestandteil werden.[25] Eine umfangreiche Untersuchung aus Massachusetts quantifizierte die Nahrungszusammensetzung während der Brutzeit und außerhalb dieser. Während der Brutzeit wurden 83,5 % Säugetiere, 12 % Vögel und 4,5 % Insekten festgestellt, außerhalb der Brutzeit 95 % Säugetiere und 5 % Vögel. Immer war die Wiesenwühlmaus das wichtigste Beutetier.[26] Dort, wo Wühlmäuse nicht vorkommen, wie zum Beispiel auf Island, bilden andere kleine Nagetiere die Nahrungsgrundlage, auf Island ist das die Waldmaus (Apodemus sylvaticus). Neben diesen Hauptbeutetieren schlägt die Sumpfohreule eine große Anzahl verschiedener Kleinsäugetiere, wie Vertreter der Echten Mäuse, etwa die Gelbhalsmaus (Apodemus flavicollis) oder die Wanderratte (Rattus norvegicus), Taschenratten, Spitzmäuse und andere bis zur Größe von jungen Hasen. Werden die Hauptbeutetiere, insbesondere Wühlmäuse, knapp, wandern Sumpfohreulen ab. Zwischenzeitlich können Vögel eine wichtige Ersatznahrung bilden. In Küstengebieten zählen sie regional zur Hauptnahrung.[27] Unter der Vogelbeute spielen neben unterschiedlichen Kleinvögeln Limikolen, Seeschwalben und kleine Arten der Möwen die bedeutendsten Rollen. Insekten-, Amphibien- und Reptilienreste wurden vereinzelt in den Gewöllen gefunden.[28] Nahrungsanalysen südamerikanischer Populationen ergaben für Südchile Abothrix olivaceus und die Wanderratte als Hauptbeutetiere.[29] Auch Nager aus der Gattung Loxodontomys können dort, vor allem in landwirtschaftlich genutzten Regionen, zu wichtigen Beutetieren werden.[30] Sumpfohreulen einer Andenpopulation in Nordwestargentinien lebten zu über 80 % von Calomys lepidus und Eligmodontia puerulus.[31] Auf den Hawaiiinseln jagen Sumpfohreulen häufig Vögel. Auf Kauaʻi ist die Art der wesentlichste Prädator der bedrohten Palmer-Drossel (Myadestes palmeri).[27]
Der tägliche Nahrungsbedarf adulter Vögel liegt bei 70–80 Gramm Beutegewicht, was etwa zwei bis drei Wühlmäusen entspricht.[27] Jungvögel benötigen in Relation dazu größere Nahrungsmengen, vor allem bei niedrigen Umgebungstemperaturen sind diese mit bis zu sieben Lemmingen pro Tag vergleichsweise sehr groß.[32]
Gewölle
Die Gewölle finden sich meist am Fuß von Sitzwarten und unter den Tagesruheplätzen. Sie sind dunkelgrau, fest und kompakt. In größeren Serien wurden Durchschnittsmaße von 48×22 Millimeter festgestellt.[33]
Jagdstrategien

Die am häufigsten praktizierte Jagdmethode der Sumpfohreule ist die Suchflugjagd. Dabei überfliegt sie in 0,5–3 Meter Höhe[34], meist gegen den Wind, ihr Jagdgebiet und kehrt an den Territoriumsgrenzen zum Ausgangspunkt zurück, um, leicht versetzt, einen neuen Suchflug zu beginnen. Der Flug ist langsam, weihenartig-gaukelnd, unruhig und vielfältig variierend durch Gleitstrecken, Rüttelphasen und Höhenkorrekturen. Die Beutetiere werden sowohl visuell als auch akustisch lokalisiert. Ist ein Beutetier geortet, rüttelt die Eule meist kurz, bevor sie sich mit vorgestreckten Zehen fallen lässt. Seltener jagen Sumpfohreulen aus größeren Höhen, wobei sie oft ausdauernd rütteln. Diese Jagdmethode scheint vor allem bei geringerem Vorkommen von Kleinsäugetieren angewandt zu werden.[35] Vor allem bei Schlechtwetter und bei geschlossener Schneedecke jagt die Art auch von Ansitzen. Entkommene oder beim ersten Angriff nur verletzte Beutetiere verfolgen Sumpfohreulen rennend oder mit Flattersprüngen. Sie können ihre Beute unter einer geschlossenen Schneedecke von bis zu 10 Zentimetern Höhe und im dichten Filz des Bodenbewuchses orten und erfolgreich schlagen.[36] Das Beutetier wird oft schon durch den Aufprall, sonst durch einen Genick- oder Kopfbiss getötet, an Ort und Stelle verschluckt oder in den Krallen (seltener im Schnabel) zu einem Fressplatz oder zum Nest transportiert. Vögeln beißt die Sumpfohreule meist Kopf und Flügel ab, bei größeren frisst sie oft nur das Brustfleisch. Bei Nahrungsüberschuss deponiert die Sumpfohreule Beutetiere im Nestbereich. Mitunter jagt die Sumpfohreule auch anderen Vögeln wie Kornweihen oder Turmfalken die Nahrung ab.
Der Jagderfolg ist vom Beutetieraufkommen und den örtlichen und klimatischen Gegebenheiten abhängig. Eine nordamerikanische Untersuchung wertete 628 Jagdversuche der Sumpfohreule aus und konnte unter diesen nur 137 sicher erfolgreiche feststellen. Eine vergleichende Untersuchung des Jagdverhaltens der Hudsonweihe und der Sumpfohreule in einem stillgelegten Tagbaugebiet in Kentucky stellte bei fast identischen Jagdmethoden und den gleichen Beutetierarten eine etwas höhere Erfolgsrate der Sumpfohreule fest. Allerdings lagen auch in dieser Untersuchung erfolgreiche Attacken mit 11 beziehungsweise 7 Prozent auf einem eher niedrigen Niveau.[37]
Verhalten
Aktivität und Komfortverhalten
Das Aktivitätsmuster der Art entspricht in etwa dem der Sperbereule. Ihre Aktivitätsgipfel liegen in den Dämmerungsstunden, sie ist aber, insbesondere in der Balz- und Brutzeit, auch am Tage aktiv. Die Mittagszeit und die Stunden um Mitternacht verbringen Sumpfohreulen meistens ruhend oder mit Komforthandlungen beschäftigt. In Gebieten, in denen Sumpfohreulen einem starken Mobbingdruck durch Möwen und Raubmöwen ausgesetzt sind, reduzieren sie ihre Tagesaktivität sehr stark oder stellen sie gänzlich ein.[38]
Die Ruhezeiten verbringt die Sumpfohreule dösend entweder in guter Deckung am Boden oder auf einem Ast, meist eng an den Stamm gedrückt. Am Boden kann sie vorgebeugt auf den Fersen sitzen oder flach ausgestreckt liegen, auf einem Ast nimmt sie eine aufrechte Position ein. In dieser tarnenden Ruhestellung ist das Gesicht schmal, die Federohren sind aufgerichtet. In der Zeit der Revierabgrenzung und während der Brutzeit ist sie am Tag häufig auf exponierten Warten zu sehen.

Sumpfohreulen widmen der Gefiederpflege viel Zeit. Sie baden ausgiebig in der Sonne, wenden dabei Gesicht und Brust der Sonne zu und lassen die Flügel hängen. In dieser Position setzen sie sich auch dem Regen aus. Baden im Sand oder Wasserbäder wurden bisher nicht beobachtet.[39]
Sozial-, Territorial- und Feindverhalten
Während der Brutzeit leben Sumpfohreulen in Paaren, doch ist ihr Sozialverhalten von gegenseitigem Distanzbedürfnis geprägt. Sie ruhen in getrennten Einständen, soziale Interaktionen wurden nicht beobachtet. Außerhalb der Brutzeit können sich in ergiebigen Nahrungsgebieten größere Gruppen zusammenfinden und in enger Nachbarschaft zueinander ruhen und gemeinsam, jedoch nicht kooperativ, jagen. Manchmal sind diese Gruppen mit Waldohreulen und Hudsonweihen vergesellschaftet.[40][41]
Während der Brutzeit ist die Sumpfohreule streng territorial. Das Revier wird akustisch durch Rufe und Flügelklatschen, optisch durch Revierflüge und auffälliges Sitzen auf exponierten Warten markiert. Eindringlingen, und zwar sowohl Artgenossen als auch anderen Eulen, Greifvögeln oder Krähen, fliegen Sumpfohreulen entgegen und versuchen sie durch Flugmanöver abzudrängen. Zuweilen kommt es zu echten Berührungskämpfen. Eindrucksvoll können Rivalenkämpfe sein, deren Hauptelement das Hochfliegen der Gegner mit vorgestreckten Krallen ist. Manchmal stürzen sie ineinander verkrallt zu Boden und verfolgen einander dort unter kreischenden, miauenden Rufen. Kommen Raubsäugetiere, Weidetiere oder Menschen dem Nest zu nahe, greifen Sumpfohreulen entweder direkt an oder versuchen, diese nach Art vieler Bodenbrüter durch Verleiten abzulenken und so vom Nest fernzuhalten. Greifvögel, insbesondere Weihen, Möwen und Raubmöwen attackiert die Art besonders nachdrücklich.
Außerhalb der Brutzeit hassen Sumpfohreulen weiterhin intensiv auf Greifvögel, Krähen, Möwen und Raubmöwen, vertrauen aber bei Annäherung von Bodenfeinden und Menschen meist auf ihre Tarnung und ducken sich in den dichten Bodenbewuchs.
Brutbiologie
Balz, Paarbildung und Nest
_-_Asio_flammeus_(062d).jpg.webp)
Sumpfohreulen werden im Herbst ihres ersten Lebensjahres geschlechtsreif. Die meisten scheinen im darauf folgenden Frühjahr erstmals zu brüten. Soweit bekannt, führen sie eine monogame Saisonehe.
Die Balz kann schon im Winterquartier beginnen, erreicht ihren Höhepunkt aber mit der Revierabgrenzung im Brutterritorium. Hauptelement der Balz und der Revierabgrenzung sind die von häufigen Rufen begleiteten Imponierflüge des Männchens. Dabei steigt es mit auffallend langsamen, übertrieben ausholenden Flügelschlägen in beträchtliche Höhen auf und präsentiert dabei die hellen Flügelunterseiten. Am Höhepunkt dieser Flugbahn, die immer über dem Revier bleibt, kippt es abrupt steil abwärts und klatscht während dieses Sturzfluges in rascher Folge mit den Flügeln. Stärker sexuell motivierte Balzelemente sind der langsame Imponierflug in extremer V-Stellung und der Schaukelflug, bei dem die Eule durch den asymmetrischen Flügelschlag abwechselnd vor- und zurückkippt. Über einem ins Auge gefassten Nistplatz verharrt das Männchen und gleitet trudelnd zu Boden. Wenn sich das Weibchen unter Flügelklatschen und Revierrufen ebenfalls niederlässt, ist die Paarbildung meist abgeschlossen. Beuteübergaben leiten zu den ersten Kopulationen über, die immer am Boden stattfinden.[42]
Sumpfohreulen gehören zu den wenigen Eulenarten, die regelmäßig Nester bauen, das Ausmaß der Nestbauhandlungen ist jedoch individuell sehr verschieden. Die Nester können einfache, nur leicht ausgescharrte oder niedergesessene Mulden sein, können aber auch aus verschiedenen Materialien der Umgebung gefertigte und mit Nistmaterial ausgelegte kompakte Konstruktionen sein. Eiablagen auf völlig unadaptiertem Untergrund kommen vor, sind aber selten.[43] Das Nest befindet sich immer auf dem Boden im dichten Bodenbewuchs, nach Möglichkeit auf trockenem, manchmal leicht erhöhtem Untergrund. Häufig befinden sich Warten, von denen das Männchen die Umgebung überwachen kann, in unmittelbarer Nähe. Da Sumpfohreulen immer in einiger Entfernung vom Nest landen, führen oft tunnelartige Laufgänge zum Nest.
Gelege und Brut
In Europa und Nordamerika beginnt die Eiablage Mitte März und erreicht ihren Höhepunkt im April. Frische Gelege können bis in den Juni und Juli gefunden werden. In hochnordischen Gebieten beginnen Sumpfohreulen frühestens im Juni mit der Brut. In Ausnahmefällen, wohl bei außergewöhnlich guter Versorgungslage, kann es zu Herbst- oder zu Winterbruten kommen.[44] Aus Südamerika liegen nur vereinzelte Angaben vor, die als Hauptbrutzeit den südamerikanischen Frühling und Frühsommer vermuten lassen. Brütende Sumpfohreulen wurden im September in den kolumbianischen Andengebieten und im November in Patagonien festgestellt.[45]
Sumpfohreulen brüten einmal im Jahr, in besonders guten Mäusejahren auch zweimal. Ersatzgelege dürften vorkommen, wurden bisher aber nicht mit Sicherheit nachgewiesen, da die Art nach Gelegeverlust das Brutgebiet meist verlässt.[46] In schlechten Mäusejahren schreiten die Eulen überhaupt nicht zur Brut, oder die Gelege sind sehr klein.
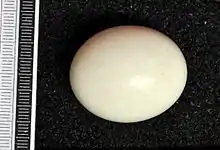
Ein Vollgelege besteht aus 7–10, (4–14) mattglänzenden, rund- bis längsovalen, anfangs reinweißen Eiern von durchschnittlich 40,4 × 31,3 Millimetern Größe und einem Frischgewicht von etwa 22 Gramm. Sie werden im Abstand von zwei Tagen gelegt und ab dem ersten Ei ausschließlich vom Weibchen bebrütet. Es verlässt während der Brutzeit und in der ersten Zeit der Jungenaufzucht das Nest nur selten und wird vom Männchen mit Nahrung versorgt. Nach einer Brutzeit von 26–29 Tagen schlüpfen die Küken entsprechend dem Legeabstand, sodass sich in einer Sumpfohreulenbrut Küken und Nestlinge in äußerst unterschiedlichen Entwicklungsstadien versammeln.[4] Tötung der jüngeren Jungen sowohl durch Geschwister als auch durch das Weibchen scheint nicht selten zu sein.[47] Ob das Deponieren überschüssiger Beutetiere in der Nestumgebung dieser Neigung zum Fratrizid entgegenwirken soll, ist ungewiss.[48] Im Extremfall verlässt der älteste Nestling bereits das Nest, wenn das letzte Küken schlüpft. Nach etwa 12–18 Tagen verteilen sich die noch nicht flug-, jedoch gut lauffähigen Jungeulen in der dichten Vegetation der Nestumgebung. Sie werden auch nach Erreichen der vollen Flugfähigkeit mit etwa 35 Tagen noch einige Zeit von beiden Eltern versorgt. Welche Rolle die Eltern in der weiteren Entwicklung der juvenilen Eulen spielen, ist nicht bekannt, ein loser Familienzusammenhang wurde bis zum Wegzug im Herbst beobachtet.[49]

Bruterfolg und Lebenserwartung
Die Ausfliegerate hängt von der Nahrungsverfügbarkeit, den Wetterverhältnissen und dem Prädationsdruck durch verschiedene Bodenfeinde wie Füchse, Wölfe und Marder sowie durch Greifvögel, Krähen, Möwen und Raubmöwen ab. Im Donaumoos schlüpften aus 121 Eiern 44 Junge, von denen 33 das Nest verließen.[47] In Manitoba flogen aus 235 Eiern 174 Jungeulen aus.[50] Dagegen wurde in einer Untersuchung in Alaska nur in 50 % der Nester wenigstens eine ausgeflogene Jungeule festgestellt.[49]
Als bisheriges Höchstalter einer freilebenden Sumpfohreule wurden 20 Jahre und 9 Monate festgestellt. Es handelte sich dabei um eine auf Spiekeroog nestjung beringte Eule, die dort wieder tot aufgefunden wurde. Die durchschnittliche Lebenserwartung ist bei dieser Art jedoch wesentlich geringer. Sie ist als Bodenbrüter und Zugvogel vielfältigen Gefahren ausgesetzt.[51]
Systematik
Die Sumpfohreule ist ein Vertreter der Gattung der Ohreulen (Asio), der 8 Arten angehören. Sie ist sehr nahe mit der afrikanischen Kap-Ohreule (Asio capensis) verwandt. Von König und Weick werden sieben Unterarten anerkannt:[4]
- Asio flammeus flammeus (Pontoppidan, 1763): Die Nominatform ist in Europa, Asien und Nordamerika verbreitet.
- A. f. bogotensis Chapman, 1915: Diese Unterart kommt im nördlichen Südamerika, auf Trinidad und Tobago und in den Anden bis ins nördliche Peru vor. Die Eulen dieser Unterart sind kleiner und dunkler als die Nominatform.
- A. f. suinda (Vieillot, 1817): Bewohnt das zentrale und südliche Südamerika bis Feuerland. Sie gleicht in Größe und Färbung weitgehend der Nominatform. Auf der Brust weist sie eine rötlichbraune, Y-förmige Zeichnung auf.
- A. f. sanfordi (Bangs, 1919): Inselrasse der Falklandinseln. Etwas kleiner und heller als ssp. suinda.
- A. f. sandwichensis (Bloxam, 1817): Diese kleine, gelblich-graue Unterart kommt auf einigen der Hawaii-Inseln vor.
- A. f. ponapensis Mayr, 1933: Eher kleine, vor allem kurzflügelige Inselrasse von den Karolinen, vor allem Pohnpei.
- A. f. domingensis (Statius Müller, 1776): Diese Unterart kommt auf den Großen und einigen der Kleinen Antillen vor.
Das Handbook of the Birds of the World nennt zusätzlich:[52]
- A. f. portoricensis Ridgway, 1882: Puerto Rico; sehr ähnlich A. f. domingensis.
- A. f. pallidicaudus Friedmann, 1949: Sehr ähnlich A. f. bogotensis. Nord- und nördliches Zentralvenezuela, Guyana; vielleicht auch Suriname und Französisch-Guayana.
- A. f. cubensis Garrido, 2007: Sehr ähnlich A. f. bogotensis. Kuba.
Die Galápagos-Ohreule Asio galapagoensis (Gould, 1837) wird derzeit mehrheitlich als eigenständige Art aufgefasst.
Bestand, Bestandsentwicklung und Gefährdungsursachen
Die Bestandssituation dieser nomadisch und vagabundierend lebenden Art ist schwer einzuschätzen. Laut IUCN ist der weltweite Bestand der Art nicht gefährdet, doch fehlen für weite Gebiete detaillierte Bestandsangaben.[53] In Europa ist der Bestand nach den massiven Einbrüchen in der zweiten Hälfte des 20. Jahrhunderts weitgehend stabil, nur in Großbritannien, den Niederlanden, in Schweden und in Belarus geht er weiter zurück.[54] Eine umfangreiche populationsdynamische Erfassung bodenbrütender Vögel in Steppengebieten der Transwolgaregion ergab für die Sumpfohreule einen stabilen Befund.[55] In Nordamerika geht der Bestand der Sumpfohreule in den meisten Regionen zurück, in einigen Bundesstaaten vor allem der östlichen USA ist die Art in den letzten Jahrzehnten ausgestorben.[56]
Der europäische Gesamtbestand wird auf mindestens 58.000 Brutpaare geschätzt. Nach dem europäischen Teil Russlands gibt es die größten Bestände dieser Art in den skandinavischen Ländern.
Neben vielen natürlichen Gefährdungen leiden Sumpfohreulen besonders unter Meliorationen von Feuchtgebieten. Die starken Bestandseinbußen in Europa und Nordamerika in der zweiten Hälfte des 20. Jahrhunderts sind vor allem auf solche Maßnahmen zurückzuführen. Wenn Sumpfohreulen in landwirtschaftlich genutzte Gebiete wie Mähwiesen oder Getreidefelder ausweichen, werden während der Mahd beziehungsweise Ernte sehr viele Bruten zerstört. Naturschützer richten nach Möglichkeit, in Absprache mit dem örtlichen Landwirt, eine Schutzzone im Radius von rund 40 m bzw. einer Fläche von 70 X 70 m um den Brutplatz ein, welche erst nach Ausfliegen der Jungeulen gemäht wird. Die Landwirte erhalten dafür Ausgleichszahlungen.[57]
Die Art erleidet auf ihren Zügen und Wanderungen große Verluste durch direkten Abschuss sowie durch Unfälle an Stromleitungen, Windkraftanlagen oder Weidezäunen.
In Deutschland gilt die Sumpfohreule als vom Aussterben bedroht (Rote Liste Kat. 1).[58]
Die Art gehört zum Anhang I der EU-Vogelschutzrichtlinie (RL 79/409/EWG).
Trivia
Der Asteroid (8752) Flammeus wurde am 2. Februar 1999 nach der Sumpfohreule benannt (wissenschaftlicher Name: Asio flammeus). Zum Zeitpunkt der Benennung befand sich die Sumpfohreule auf der niederländischen und europäischen Roten Liste gefährdeter Vogelarten.[59]
Literatur
- Adrian Aebischer: Eulen und Käuze. Auf den Spuren nächtlicher Jäger. Haupt-Verlag Bern 2008. ISBN 978-3-258-07276-0
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas (HBV). Band 9: Columbiformes–Piciformes. 2. Auflage. Aula-Verlag, Wiesbaden 1994, ISBN 3-89104-562-X.
- Roy Brown, John Ferguson, Michael Lawrence, David Lees: Federn, Spuren & Zeichen der Vögel Europas. AULA Wiebelsheim 2003³. ISBN 3-89104-666-9
- James R. Duncan: Owls of the World. Firefly Books, Buffalo 2003, ISBN 1-55297-845-1
- Denver W. Holt, Shawne M. Leasure, David A. Wiggins: Short Eared Owl (Asio flammeus). In: The Birds of North America Online (A. Poole, Ed.). Ithaca: Cornell Lab of Ornithology.
- Jochen Hölzinger, Ulrich Mahler: Die Vögel Baden-Württembergs. Nicht-Singvögel 3. Verlag Eugen Ulmer Stuttgart 2001. ISBN 3-8001-3908-1
- Theodor Mebs, Wolfgang Scherzinger: Die Eulen Europas. Kosmos, Stuttgart 2000, ISBN 3-440-07069-7
- Claus König, Friedhelm Weick: Owls of the World. Christopher Helm, London 2008, ISBN 978-0-7136-6548-2
- P. D. Olsen, G. M. Kirwan und D. A. Christie: Short-eared Owl (Asio flammeus). In: J. del Hoyo, A. Elliott, Jordi Sargatal, D. A. Christie und E. Juana (Hrsg.): Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. 2013 (abgerufen am 26. April 2015 auf http://www.hbw.com/node/55128).
Weblinks
- Deutsche Arbeitsgemeinschaft zum Schutz der Eulen (AG Eulen)
- Die Sumpfohreule auf der Seite der Gesellschaft zur Erhaltung der Eulen
- Sumpfohreule auf owlpages.com (englisch)
- Asio flammeus in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: BirdLife International, 2008. Abgerufen am 31. Januar 2009.
- Videos, Fotos und Tonaufnahmen zu Asio flammeus in der Internet Bird Collection
- xeno-canto: Tonaufnahmen – Short-eared Owl (Asio flammeus)
- Alters- und Geschlechtsmerkmale (PDF; 3,7 MB) von J. Blasco-Zumeta und G.-M. Heinze (engl.)
- Federn der Sumpfohreule
Einzelnachweise
- HBV Bd. 9. (1994) S. 423
- HBV Bd. 9. (1994) S. 426
- Mebs, Scherzinger, 2000, S. 270
- König, Weick, 2008, S. 485
- Mebs, Scherzinger, 2000, S. 278
- HBV Bd. 9 (1994) S. 426
- Aebischer (2008) S. 107
- König, Weick, 2008, S. 202, 482, 484
- Pertti Saurola: Bad news and good news: population changes of Finnish owls during 1982–2007. In: ARDEA 97 (4): 469 – 482
- König, Weick, 2008, S. 486–487
- Bestandssituation in Großbritannien und Irland. (PDF; engl.; 29 kB)
- Hölzinger (2001) S. 236
- Thomas Rödl, Bernd-Ulrich Rudolph, Ingrid Geiersberger, Kilian Weixler, Armin Görgen: Atlas der Brutvögel in Bayern. Verbreitung 2005 bis 2009. Verlag Eugen Ulmer, Stuttgart 2012, S. 122
- seaturtle.org
- Mebs, Scherzinger, 2000, S. 284
- Wiggins, Holt, Leasure: Migration. 2006
- HBV Bd. 9. (1994) S. 435–436
- HBV Bd. 9 (1994) S. 436
- Urs N. Glutz von Blotzheim, Kurt M. Bauer: Handbuch der Vögel Mitteleuropas, Band 9. Columbiformes – Piciformes. Aula-Verlag, Wiesbaden 1980, S. 435
- Wiggins, Holt, Leasure: Habitat. 2006
- Hölzinger (2001) S. 241
- Hölzinger (2001) S. 242
- Mebs, Scherzinger, 2000, S. 272
- Wiggins, Holt, Leasure: Territoriality. 2006
- Wilson Bull., 105(3), 1993, S. 497–503 (PDF; engl.; 323 kB)
- Wilson Bull., 105(3), 1993, S 490-496. pdf, engl
- Wiggins, Holt, Leasure: Food Habits. 2006
- HBV Bd. 9 (1994) S. 449 und 450
- Raptor Research 32(2):111-115 (1998) (PDF; engl.; 611 kB)
- Pablo Teta et al.: Loxodontomys micropus (Rodentia: Cricetidae). In: Mammalian Species 837:1–11
- Raptor Research 35(1):68-69 (2001) (PDF; engl.; 207 kB)
- HBV Bd. 9 (1994) S. 451
- HBV Bd. (1994) S. 445
- Clark, R. J.: A field study of the short-eared owl, Asio Flammeus (Pontoppidan), in North America. Hrsg.: Wildlife Monographs. 1975.
- HBV Bd. 9. S. 444
- Mebs, Scherzinger. 2000, S. 279
- Mark Vukovich, Gary Ritchison: Foraging Behavior of Short-eared Owls and Northern Harriers on a Reclaimed Surface Mine in Kentucky. In: Southeastern Naturalist 7(1): S. 1–10; 2008
- Condor 62:6 (1960) S. 486. (PDF; engl.; 149 kB)
- Mebs, Scherzinger, 2000, S. 274
- Mebs, Scherzinger, 2000, S. 276
- Donald S. Heintzelman: Hawks and Owls of Eastern North America. Rutgers University Press, 2004, ISBN 0-8135-3350-3, S. 66.
- Mebs, Scherzinger, 2000, S. 280–281
- Hölzinger (2001) S. 244
- HBV Bd. 9. (1994) S. 441
- Wiggins, Holt, Leasure: Breeding. 2006
- Hölzinger (2001) S. 246
- Hölzinger (2001) S. 247
- The Auk 79 (1959) S. 222 f. (PDF; engl.; 575 kB)
- HBV Bd. 9. (1994) S. 442
- Wiggins, Holt, Leasure: Demography and Populations. 2006
- Euring Datenblatt (engl.)
- Handbook of the Birds …
- Factsheet auf BirdLife International
- Datenblatt Birdlife europe (PDF; engl.)
- M. L. Oparin: Recent Fauna of Ground-Nesting Birds in Transvolga Steppes and its Dynamics in the 20th Century. In: Biology Bulletin, 2008, Vol. 35, No. 4, S. 422–427. © Pleiades Publishing, Inc., 2008. ISSN 1062-3590
- fs.fed.us (PDF-Datei; 1,8 MB)
- Thorsten Krüger (2018): Sumpfohreulen (Asio flammeus) als Brutvögel in Mähwiesen: Gefährdung und Schutz. Vogelwelt 139: 183-201.
- Christoph Grüneberg, Hans-Günther Bauer, Heiko Haupt, Ommo Hüppop, Torsten Ryslavy, Peter Südbeck: Rote Liste der Brutvögel Deutschlands, 5 Fassung. In: Deutscher Rat für Vogelschutz (Hrsg.): Berichte zum Vogelschutz. Band 52, 30. November 2015.
- Lutz D. Schmadel: Dictionary of Minor Planet Names. Springer, Heidelberg 2003, 5. Auflage, Seite 664 (englisch)