Fenipentol
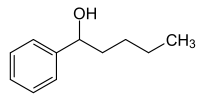
Fenipentol ist ein Arzneistoff, der die Gallesekretion anregt und daher zur Gruppe der Choleretika gehört. Der Arzneistoff besitzt ein Stereozentrum, ist also chiral und liegt als Racemat [1:1-Gemisch des (R)-Isomeres und des (S)-Isomeres] vor.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Fenipentol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C11H16O | |||||||||||||||
| Kurzbeschreibung |
farblose bis leicht gelbliche Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
A05AX07 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 164,24 g·mol−1 | |||||||||||||||
| Dichte | ||||||||||||||||
| Löslichkeit |
mischbar mit organischen Flüssigkeiten, praktisch nicht mischbar mit Wasser[1] | |||||||||||||||
| Brechungsindex |
1,4086 (25 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
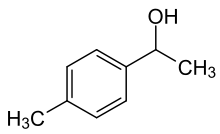
Er wurde synthetisch aus einem gallenwirksamen Inhaltsstoff der Kurkuma-Pflanze (Curcuma domestica), dem p-Tolylmethylcarbinol [nach IUPAC: 1-(4-Methylphenyl)ethanol] abgeleitet. Seine Toxizität ist geringer als die der Muttersubstanz.
Synthese
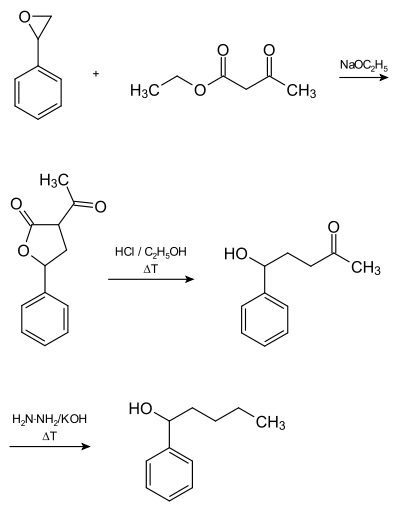
Ein möglicher Syntheseweg geht von Styrolepoxid aus. Styrolepoxid reagiert in Gegenwart von Natriumethanolat mit Acetessigester zu α-Acetyl-γ-phenyl-γ-butyrolacton, welches durch Erhitzen in ethanolischer Salzsäure unter Abspaltung von Kohlenstoffdioxid zu 5-Hydroxy-5-phenyl-pentanon weiterreagiert. Durch Erhitzen unter Rückfluss mit Hydrazin und Kaliumhydroxid entsteht in einer Wolff-Kishner-Reaktion das Fenipentol.[5]
Ein weiterer Syntheseweg ist die Umsetzung von Benzaldehyd mit n-Butylmagnesiumbromid, der Grignardverbindung aus n-Butylbromid und Magnesium und anschließender Hydrolyse.[4]
Handelsnamen
Febichol (D, außer Handel)
Literatur
- Hermann J. Roth u. Helmut Fenner: Arzneistoffe. Thieme, Stuttgart u. New York 1988. S. 598–599.
Einzelnachweise
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 679, ISBN 978-0-911910-00-1.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-430.
- Datenblatt 1-PHENYL-1-PENTANOL bei Sigma-Aldrich, abgerufen am 31. März 2011 (PDF).
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications, 4. Auflage (2001) Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- Siegfried Ebel: Hagers Handbuch der Pharmazeutischen Praxis. Springer, 1999, ISBN 978-3-540-62644-2, S. 500 (eingeschränkte Vorschau in der Google-Buchsuche).