Shi-Epoxidierung
Die Shi-Epoxidierung ist eine Namensreaktion der Organischen Chemie. Als Shi-Epoxidierung bezeichnet man die organokatalytische asymmetrische Epoxidierung von Alkenen mithilfe von chiralen Dioxiranen auf Basis von Fructose Derivaten.[1][2][3]
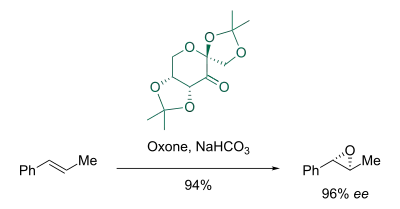
Die Reaktion verläuft mit sehr hohen Enantioselektivitäten.[4][5] Ein Vorteil der Shi-Epoxidierung ist, dass unfunktionalisierte trans-Alkene in Epoxide überführt werden können.[6] Die Fructosederivate der Shi-Epoxidierung (auch Shi-Katalysatoren genannt) sind Organokatalysatoren, welche durch ein Oxidationsmittel (meist Oxone) in chirale Dioxirane überführt werden, welche dann die Alkene epoxidieren.[7]
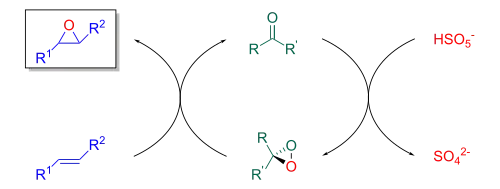
Da die Reaktion auf Fructosederivaten basiert, verläuft sie metallfrei. Dioxirane gelten als umweltfreundliche und vielseitige Oxidationsmittel.[8] Die Reaktion ist nach dem chinesischen Chemiker Yian Shi benannt, welcher die Methode 1996 veröffentlichte.[9] Die Shi-Epoxidierung ist ein wichtiges Beispiel für asymmetrische Organokatalyse und hat breite Anwendung in der Synthese gefunden.[10][11] Die ersten Grundlagen zur Epoxidierung von Alkenen mithilfe von chiralen Ketonen wurde 1984 von Ruggero Curci publiziert.[12]
Reaktionsmechanismus
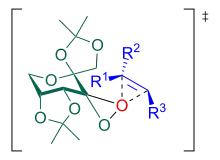
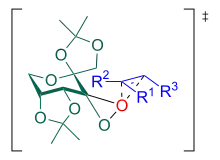
Die Reaktion kann über einen Spiro-Übergangszustand oder einen planaren Übergangszustand verlaufen, wobei in fast allen Fällen bei trans-disubstituierten und trisubstituierten Olefinen ein Spiro-Übergangszustand angenommen wird.[13] Die Kontrolle des pH-Wertes ist für die Reaktion von entscheidender Bedeutung: bei zu hohem pH-Wert zersetzen sich Oxone, während bei zu niedrigem pH-Wert eine Baeyer-Villiger-Umlagerung als Nebenreaktion abläuft.[14] Hinzu kommt, dass sich Epoxide im Sauren zersetzen. Für einen Shi-Katalysator auf Basis von ᴅ-Fructose ergibt sich folgender Katalysezyklus:
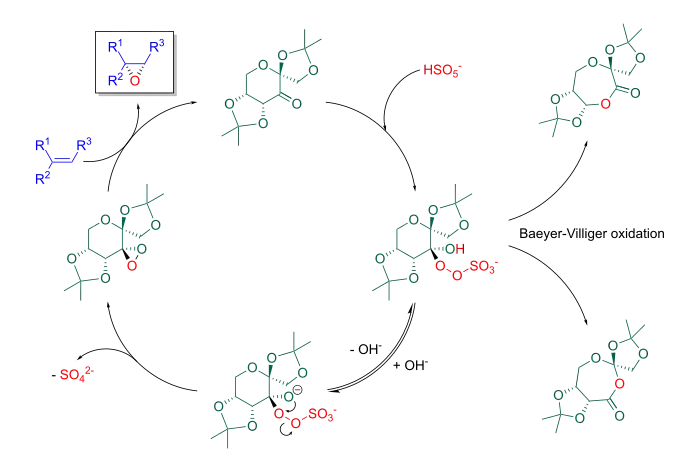
Synthese von Shi-Katalysatoren
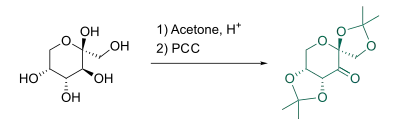
Die Shi-Katalysatoren sind durch einfache Syntheseschritte direkt aus diversen Zuckern zugänglich. So kann ᴅ-Fructose durch säurekatalysierte Acetalbildung und nachfolgender Oxidation mit PCC in folgenden Shi-Katalysator überführt werden:[15]
Siehe auch
Literatur
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier, ISBN 978-0124297852.
Einzelnachweise
- Yian Shi: Organocatalytic Asymmetric Epoxidation of Olefins by Chiral Ketones. In: American Chemical Society (Hrsg.): Accounts of chemical research / vol. 37, no. 8, 2004. 2004, doi:10.1021/ar030063x.
- Rebecca L. Davis, Julian Stiller, Tricia Naicker, Hao Jiang, Karl Anker Jørgensen: Asymmetric Organocatalytic Epoxidations: Reactions, Scope, Mechanisms, and Applications. In: Angewandte Chemie International Edition (Hrsg.): Angew. Chem. Int. Ed. 2014, 53, 7406 – 7426. 11. Juni 2014, doi:10.1002/anie.201400241.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, ISBN 978-0-12-429785-2, S. 410, 676.
- Yong Tu, Zhi-Xian Wang, and Yian Shi: An Efficient Asymmetric Epoxidation Method for trans-Olefins Mediated by a Fructose-Derived Ketone. In: Journal of the American Chemical Society (Hrsg.): J. Am. Chem. Soc. 1996, 118, 40, 9806–9807. 9. Oktober 1996, doi:10.1021/ja962345g.
- Yingguang Zhu, Qian Wang, Richard G. Cornwall, Yian Shi: Organocatalytic Asymmetric Epoxidation and Aziridination of Olefins and Their Synthetic Applications. In: American Chemical Society (Hrsg.): Chem. Rev. 2014, 114, 8199–8256. 1. Mai 2014, doi:10.1021/cr500064w.
- Erick M. Carreira, Lisbet Kvaerno: Classics in Stereoselective Synthesis. Wiley-VCH, 2009, ISBN 978-3-527-29966-9, S. 274.
- Jerry March, Michael B. Smith: March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. 8. Auflage. Wiley, ISBN 978-1-119-37180-9, S. 1014.
- Laszlo Kurti, Barbara Czako: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, ISBN 978-0-12-429785-2, S. 410, 676.
- Yong Tu, Zhi-Xian Wang, and Yian Shi: An Efficient Asymmetric Epoxidation Method for trans-Olefins Mediated by a Fructose-Derived Ketone. In: Journal of the American Chemical Society (Hrsg.): J. Am. Chem. Soc. 1996, 118, 40, 9806–9807. 9. Oktober 1996, doi:10.1021/ja962345g.
- Yingguang Zhu, Qian Wang, Richard G. Cornwall, Yian Shi: Organocatalytic Asymmetric Epoxidation and Aziridination of Olefins and Their Synthetic Applications. In: American Chemical Society (Hrsg.): Chem. Rev. 2014, 114, 8199–8256. 1. Mai 2014, doi:10.1021/cr500064w.
- Zhaoming Xiong, E. J. Corey: Simple Enantioselective Total Synthesis of Glabrescol, a Chiral C 2 Symmetric Pentacyclic Oxasqualenoid. In: Journal of the American Chemical Society (Hrsg.): J. Am. Chem. Soc. Band 122 (38), 2000, S. 9328–9329, doi:10.1021/ja0024901.
- Ruggero Curci, Michele Fiorentino, Maria R. Serio: Asymmetric epoxidation of unfunctionalized alkenes by dioxirane intermediates generated from potassium peroxomonosulphate and chiral ketones. In: Royal Society of Chemistry (Hrsg.): J. Chem. Soc., Chem. Commun., 1984, 155-156. doi:10.1039/C39840000155.
- Laszlo Kurti, Barbara Czako: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, ISBN 978-0-12-429785-2, S. 410, 676.
- Laszlo Kurti, Barbara Czako: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, ISBN 978-0-12-429785-2, S. 410, 676.
- Yian Shi: Organocatalytic Asymmetric Epoxidation of Olefins by Chiral Ketones. In: American Chemical Society (Hrsg.): Accounts of chemical research / vol. 37, no. 8, 2004. 2004, doi:10.1021/ar030063x.