Rhodocen
Rhodocen [Rh(C5H5)2], genauer bezeichnet als Bis(η5-Cyclopentadienyl)rhodium(II), ist eine metallorganische Verbindung aus der Reihe der Metallocene. Im Molekül liegt ein Rhodiumatom zwischen zwei Cyclopentadienyl-Ringen in einem Sandwichkomplex.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Rhodocen | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C10H10Rh | |||||||||
| Kurzbeschreibung |
gelber Feststoff (dimer)[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 233,09 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
Dimer bedingt löslich in Dichlormethan, löslich in Acetonitril[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Eigenschaften
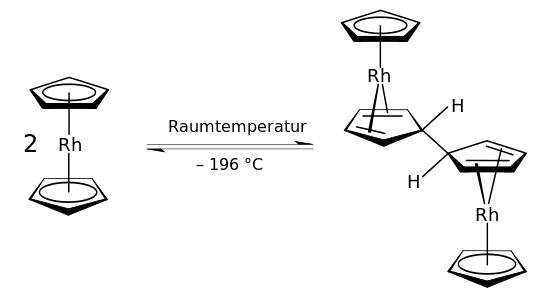
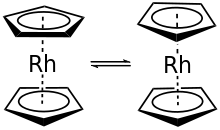
Beim Rhodocen [Rh(C5H5)2] handelt es sich um einen radikalischen 19-Elektronen-Komplex, welcher nur bei Temperaturen über 150 °C oder durch Kühlung auf die Temperatur von flüssigem Stickstoff (−196 °C) gefunden werden kann. Bei Raumtemperatur (25 °C) wandelt sich Rhodocen in Acetonitril in weniger als 2 Sekunden durch Dimerisierung (Kombination) zu [Rh(C5H5)2]2, einem diamagnetischen 18-Valenzelektronen-Komplex um, in welchem zwei Rhodocen-Einheiten über Cyclopentadienylringe miteinander verbunden sind.[1][3][4][5] Dimeres Rhodocen Rh(C5H5)2]2 ist ein gelber Feststoff.
Messungen mittels Elektronenspinresonanzspektroskopie (ESR), Kernspinresonanzspektroskopie (NMR) und Infrarotspektroskopie (IR) weisen darauf hin, dass es ein Gleichgewicht zwischen der monomeren und dimeren Form gibt.[4] ESR Daten zeigen, dass das Monomer eine Achsensymmetrie höherer Ordnung Cn, (n > 2) mit einer Spiegelebene (σ) senkrecht zur Molekülsymmetrieebene besitzt, was bedeutet, dass das Monomer die typische Sandwichstruktur der Metallocene hat.[3][Anm 1] Die Interpretation dieser Daten wurde aber durchaus in Zweifel gestellt.[5] Der Fragmentierungsweg des Monomers wurde massenspektrometrisch untersucht.[6] Bei der Dimerisierung handelt es sich formal um eine Redoxreaktion, das Dimer ist eine Rhodium(I)-Verbindung, während das Monomer eine Rhodium(II)-Verbindung ist. In stabilen Komplexen tritt Rhodium üblicherweise in den Oxidationsstufen +I oder +III auf.[7] Durch die Dimerisierung reduziert sich die Anzahl der Valenzelektronen am Rhodiumkern von 19 auf 18, da durch die oxidative Kupplung der beiden Cyclopentadienylringe Liganden mit geringerer Haptizität entstehen. Während im Monomer beide Cp-Ringe η5 an das Zentralatom gebunden sind, ist im Dimer ein Ring η5-, der andere η4-gebunden. Dabei ist der η4-gebundene Ring für das Rhodium(I)-Metallzentrum ein 4-Elektronen-Donor, im Gegensatz zum η5-gebundenen 6-Elektronen-Liganden.[Anm 2] Die erhöhte Stabilität des dimeren 18-Valenzelektronen-Rhodium(I)-Komplexes im Vergleich zum monomeren 19-Valenzelektronen-Rhodium(II)-Komplex erklärt auch leicht, dass das Monomer nur unter extremen Bedingungen beobachtet werden kann.[1][4] Es wurde von El Murr et al. angenommen und auch von Fischer and Wawersik aufgrund von 1H-NMR-Daten gefolgert, dass im Rodocen-Dimer die Wasserstoffatome der verbundenen Cp-Ringe in endo Position (d. h. zum Zentralatom hin gerichtet) liegen.[1][3] Dagegen gehen Collins et al. davon aus, dass sich die Wasserstoffatome in exo-Position befinden.[8]
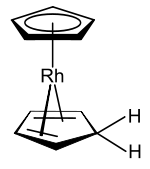
Cotton and Wilkinson konnten zeigen, dass das Rhodocenium-Kation [Rh(η5-C5H5)2]+ mit 18 Valenzelektronen in wässriger Lösung zur monomere Form reduziert werden kann.[9] Es war ihnen jedoch nicht möglich, das neutrale Produkt zu isolieren, nicht nur, weil es rasch dimerisiert, sondern auch weil sich das Rhodocenradikal spontan zum [(η5-C5H5)Rh(η4-C5H6)] umwandelt, einen stabilen 18-Elektronen-Rhodium(I)-Komplex mit gemischter Haptizität.[3] Dieser Komplex unterscheidet sich vom Rhodocen in zwei Punkten:
- ein Cyclopentadienylligand wurde durch Addition eines Wasserstoffatoms zum Cyclopentadien, welches als η4 4-Elektronen-Donor gebunden bleibt
- das Rhodium(II)-Zentrum wird zum Rhodium(I) reduziert
E. O. Fischer et al. nahmen an, dass sich dieser Komplex in separaten Schritten durch Protonierung und Reduktion bildet.[3] Es konnte gezeigt werden, dass dieser Komplex auch durch Reduktion einer Rhodocenium-Lösung mit Natriumborhydrid in wässrigem Ethanol hergestellt werden kann.[10] Hier wurde das Produkt als Biscyclopentadienylrhodiumhydrid charakterisiert.
Octaphenylrhodocen (ein Derivat mit acht Phenylgruppen) ist das erste substituierte Rhodocen, welches bei Raumtemperatur isoliert wurde, obwohl auch dieses sich rasch an der Luft zersetzt. Die Röntgenstrukturanalyse zeigte, dass Octaphenylrhodocen eine Sandwichstruktur mit gestaffelter Konformation hat.[8] Im Gegensatz zum Cobaltocen, welches als Ein-Elektronen-Reduktionsmittel erfolgreich in die Forschung Einzug gehalten hat,[11] wurde bisher kein Rhodocen-Derivat entdeckt, welches eine ausreichende Stabilität für eine solche Anwendung hat.
Darstellung
Nur 2 Jahre nachdem Ferrocen entdeckt wurde, wurden die ersten Rhodocenium-Salze hergestellt. Bei der ersten Synthese wurde Cyclopentadienylmagnesiumbromid (C5H5MgBr) mit Tris(acetylacetonato)rhodium(III) umgesetzt.[9] Über zahlreiche andere Reaktionswege, inklusive Gasphasen-Redox-Transmetallierung mit Ferrocen oder Nickelocen oder dem Einsatz von Halbsandwich-Vorstufen wurde seitdem berichtet.[12][13]
Auch über moderne Mikrowellen-Synthesemethoden wurde berichtet.[14] Rhodoceniumhexafluorphosphat bildet sich nach Umsetzung von Cyclopentadien mit Rhodium(III)-chlorid Hydrat in Methanol, gefolgt von der Aufarbeitung mit methanolischem Ammoniumhexafluorphosphat; Nach nur 30 Sekunden Mikrowellenbestrahlung erhält man das Produkt mit einer Ausbeute von über 60 %.[15]
Aufgrund ihrer Stabilität und der relativ einfachen Herstellung sind Rhodoceniumsalze üblicherweise die Ausgangssubstanzen zur Synthese von Rhodocen und substituierten Rhodocenen, welche für sich alle instabil sind. Rhodocen lässt sich z. B. durch Reaktion eines Rhodoceniumsalzes mit geschmolzenen Natrium herstellen.[3] Das Rhodecen kann dann durch Sublimation an einem mit flüssigem Stickstoff gekühlten Finger als schwarze polykristalline Substanz gewonnen werden.[5] Beim Aufwärmen auf Raumtemperatur wandelt sich diese in einen gelben Feststoff um, welcher als das Rhodocen-Dimer identifiziert werden kann.
Verwendung
Biochemiker haben die Verwendung von Rhodium-Verbindungen und deren Derivaten in der Medizin untersucht[16] und berichten über die potentielle Anwendung von Rhodocen-Derivaten als Radiopharmakon zur Behandlung kleinerer Krebs-Bereiche.[17][18] Rhodocen-Derivate werden auch zur Synthese von verbundenen Metallocenen eingesetzt, in denen Metall–Metall-Wechselwirkungen untersucht werden können.[19] Mögliche Anwendungen von Rhodocen-Derivate sind außerdem die Molekularelektronik und Forschung über die Mechanismen von Katalysatoren.[20]
Anmerkungen
- Die Anwesenheit einer Spiegelebene senkrecht zu den Symmetrieachsen weist auf eine ekliptische statt auf eine gestaffelten Konformation hin. Eine freie Rotation der Cyclopentadienylliganden entlang der Metall-Cp-Achse ist aber üblich – in Ferrocen liegt die Rotationsbarriere bei ~5 kJ mol−1. Daher sollten in Lösung gestaffelte und ekliptische Moleküle nebeneinander existieren und auch rasch ineinander übergehen. Daher ist eigentlich nur im Feststoff die Angabe einer gestaffelten oder ekliptischen Konformation wirklich sinnvoll.
- Es gibt 2 verschiedene Ansätze für die Elektronenzählung, je nachdem, ob man radikalische oder ionische Spezies betrachtet. Geht man von Radikalen aus, besitzt das Rhodiumzentrum 9 Elektronen und jeder Cyclopentadienylligand ist ein 5-Elektronen-Donor. Bei ionischen Ansatz ist der Cyclopentadienylligand ein 6-Elektronen-Donor und die Elektronenzahl des Rhodiumzentrums hängt von der Oxidationsstufe ab: Rhodium(I) besitzt acht, Rhodium(II) sieben und Rhodium(III) 6 Elektronen. Beide Ansätze liefern das gleiche Ergebnis, müssen aber jeweils separat betrachtet werden.
Einzelnachweise
- N. El Murr, J. E. Sheats, W. E. Geiger, J. D. L. Holloway: Electrochemical Reduction Pathways of the Rhodocenium Ion. Dimerization and Reduction of Rhodocene. In: Inorg. Chem.. 18, Nr. 6, 1979, S. 1443–1446. doi:10.1021/ic50196a007.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- E. O. Fischer, H. Wawersik: Über Aromatenkomplexe von Metallen. LXXXVIII. Über Monomeres und Dimeres Dicyclopentadienylrhodium und Dicyclopentadienyliridium und Über Ein Neues Verfahren Zur Darstellung Ungeladener Metall-Aromaten-Komplexe. In: J. Organomet. Chem.. 5, Nr. 6, 1966, S. 559–567. doi:10.1016/S0022-328X(00)85160-8.
- H. J. Keller, H. Wawersik: Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir. In: J. Organomet. Chem.. 8, Nr. 1, 1967, S. 185–188. doi:10.1016/S0022-328X(00)84718-X.
- B. De Bruin, D. G. H. Hetterscheid, A. J. J. Koekkoek, H. Grützmacher: The Organometallic Chemistry of Rh–, Ir–, Pd–, and Pt–Based Radicals: Higher Valent Species. In: Prog. Inorg. Chem.. 55, 2007, S. 247–354. doi:10.1002/9780470144428.ch5.
- D. V. Zagorevskii, J. L. Holmes: Observation of Rhodocenium and Substituted-Rhodocenium Ions and their Neutral Counterparts by Mass Spectrometry. In: Organometallics. 11, Nr. 10, 1992, S. 3224–3227. doi:10.1021/om00046a018.
- Simon Cotton: Chemistry of Precious Metals. Springer Science & Business Media, 1997, ISBN 978-0-751-40413-5, S. 78 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. E. Collins, M. P. Castellani, A. L. Rheingold, E. J. Miller, W. E. Geiger, A. L. Rieger, P. H. Rieger: Synthesis, Characterization, and Molecular-Structure of Bis(tetraphenylcyclopentadienyl)rhodium(II). In: Organometallics. 14, Nr. 3, 1995, S. 1232–1238. doi:10.1021/om00003a025.
- F. A. Cotton, R. O. Whipple, G. Wilkinson: Bis-Cyclopentadienyl Compounds of Rhodium(III) and Iridium(III). In: J. Am. Chem. Soc. Band 75, Nr. 14, 1953, S. 3586–3587, doi:10.1021/ja01110a504.
- M. L. H. Green, L. Pratt, G. Wilkinson: 760. A New Type of Transition Metal–Cyclopentadiene Compound. In: J. Chem. Soc.. 1959, S. 3753–3767. doi:10.1039/JR9590003753.
- N. G. Connelly, W. E. Geiger: Chemical Redox Agents for Organometallic Chemistry. In: Chem. Rev.. 96, Nr. 2, 1996, S. 877–910. doi:10.1021/cr940053x. PMID 11848774.
- D. B. Jacobson, G. D. Byrd, B. S. Freiser: Generation of Titanocene and Rhodocene Cations in the Gas Phase by a Novel Metal-Switching Reaction. In: J. Am. Chem. Soc.. 104, Nr. 8, 1982, S. 2320–2321. doi:10.1021/ja00372a041.
- H. T. He: Synthesis and Characterisation of Metallocenes Containing Bulky Cyclopentadienyl Ligands 1999., Doktorarbeit School of Chemistry, Faculty of Science, University of Sydney
- D. R. Baghurst, D. M. P. Mingos: Design and Application of a Reflux Modification for the Synthesis of Organometallic Compounds Using Microwave Dielectric Loss Heating Effects. In: J. Organomet. Chem.. 384, Nr. 3, 1990, S. C57–C60. doi:10.1016/0022-328X(90)87135-Z.
- D. R. Baghurst, D. M. P. Mingos, M. J. Watson: Application of Microwave Dielectric Loss Heating Effects for the Rapid and Convenient Synthesis of Organometallic Compounds. In: J. Organomet. Chem.. 368, Nr. 3, 1989, S. C43–C45. doi:10.1016/0022-328X(89)85418-X.
- Marcel Gielen: Metallotherapeutic Drugs and Metal-Based Diagnostic Agents. Wiley, 2005, ISBN 978-0-470-86404-3, doi:10.1002/0470864052.ch20, S. 379 (eingeschränkte Vorschau in der Google-Buchsuche).
- M. Wenzel, Y. F. Wu: Ferrocen-, Ruthenocen-bzw. Rhodocen-analoga von Haloperidol Synthese und Organverteilung nach Markierung mit 103Ru-bzw. 103mRh. In: Int. J. Rad. Appl. Instrum. A.. 39, Nr. 12, 1988, S. 1237–1241. doi:10.1016/0883-2889(88)90106-2. PMID 2851003.
- M. Wenzel, Y. F. Wu: Abtrennung von [103mRh]Rhodocen-Derivaten von den Analogen [103Ru]Ruthenocen-Derivaten und deren Organ-Verteilung. In: Int. J. Rad. Appl. Instrum. A.. 38, Nr. 1, 1987, S. 67–69. doi:10.1016/0883-2889(87)90240-1. PMID 3030970.
- S. Barlow, D. O'Hare: Metal–Metal Interactions in Linked Metallocenes. In: Chem. Rev.. 97, Nr. 3, 1997, S. 637–670. doi:10.1021/cr960083v.
- M. Wagner: A New Dimension in Multinuclear Metallocene Complexes. In: Angew. Chem. Int. Ed.. 45, Nr. 36, 2006, S. 5916–5918. doi:10.1002/anie.200601787.