Rhodium(III)-chlorid
Rhodium(III)-chlorid ist eine chemische Verbindung aus Rhodium und Chlor, die isotyp zu Aluminiumtrichlorid[3] ist. Rhodiumtrichlorid ist ein dunkelroter bis rotbrauner Feststoff, der in der Natur nur äußerst selten vorkommt. Es ist ein Rhodiumsalz der Salzsäure.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
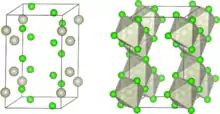 | ||||||||||
| _ Rh3+ _ Cl− | ||||||||||
| Allgemeines | ||||||||||
| Name | Rhodium(III)-chlorid | |||||||||
| Andere Namen |
Rhodiumtrichlorid | |||||||||
| Verhältnisformel | RhCl3 | |||||||||
| Kurzbeschreibung |
roter Feststoff (wasserfrei), dunkelroter Feststoff (Trihydrat)[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 209,26 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich (Trihydrat), unlöslich (wasserfrei) in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Wasserfreies Rhodium(III)-chlorid entsteht bei einer Reaktion zwischen Chlor und Rhodium bei 400 bis max. 800 °C.[1]
Das Trihydrat entsteht bei der Reaktion zwischen Chlorwasserstoffsäure mit frisch hergestelltem gelbem Rhodium(III)-oxid-Hydrat Rh2O3 · 5 H2O und vorsichtigem Eintrocknen auf dem Dampfbad.
Beim Erhitzen von RhCl3 · 3 H2O auf über 100 °C tritt Zersetzung unter Bildung von unlöslichem schwarzem Rhodium(III)-oxid (Rh2O3) ein.
Eigenschaften
Physikalische Eigenschaften
Wasserfreies bei bis zu 700 °C hergestelltes Rhodium(III)-chlorid ist ein rosenrotes bis braunrotes in Wasser und Säuren unlösliches amorphes Pulver.[1] Bei über 700 °C hergestelltes Material wird deutlich kristallin. Ab 800 °C sublimiert es zu rotgoldenen Blättchen. Das kirschrote Trihydrat mit der Formel [RhCl3(H2O)3] ist dagegen in Wasser gut löslich.[1] Wasserfreies Rhodiumtrichlorid kristallisiert monoklin, Raumgruppe C2/m (Raumgruppen-Nr. 12) mit den Gitterparametern a = 5,95 Å, b = 10,3 Å, c = 6,03 Å und β = 109,2°.[4]
Chemische Eigenschaften
Im Chlorstrom kann wasserfreies Rhodium(III)-chlorid bei 900 °C sublimiert werden. Die Farbe salzsaurer Lösungen von [RhCl3(H2O)3] schlägt langsam von rot nach gelb um. Es treten Hydratisomerien auf[1]:
Verwendung
In den 1960er Jahren zeigte sich, dass es sich als Katalysator für verschiedene Reaktionen eignet, darunter Reaktionen mit Kohlenstoffmonoxid, Wasserstoff und mit Alkenen.
Das Hydrat wird auch als Zusatz für Glanz- und Poliergold oder -platin verwendet.[1]
Einzelnachweise
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0.
- Eintrag zu Rhodium(III)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Weinheim 1988, ISBN 3-527-26169-9.
- H. Bärnighausen, B.K. Handa: Die Kristallstruktur von Rhodium(III)-chlorid. In: Journal of the Less-Common Metals, 6, 1964, S. 226–231, doi:10.1016/0022-5088(64)90103-1.



