Pyridazin
Pyridazin ist eine heterocyclische, aromatische organische Verbindung. Sie besteht aus einem sechsgliedrigen Ring, der zwei benachbarte Stickstoffatome besitzt. Die systematische Bezeichnung lautet 1,2-Diazin, die Verbindung besitzt die Summenformel C4H4N2. Pyridazin gehört zur Gruppe der Diazine und bildet den Grundkörper der Pyridazine, die isomer zu den Pyrimidinen und Pyrazinen sind.[7]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
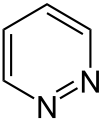 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pyridazin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H4N2 | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelb-braune Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
208 °C[3] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,52311 (23,5 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
224,9 kJ/mol[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eigenschaften
Pyridazin ist eine farblose bis gelb-braune – mit Wasser mischbare – Flüssigkeit. Ihr Hydrochlorid ist ein gelber Feststoff, der bei 161–163 °C schmilzt. Ihr Monopikrat und Chloraurat sind ebenfalls gelbe Feststoffe, die sich bei 170 °C bzw. 110 °C zersetzen.[4]
Pyridazin ist eine hückelaromatische Verbindung, die sechs π-Elektronen besitzt. Beide Stickstoffatome besitzen darüber hinaus noch je ein freies Elektronenpaar.[8] Dieses ermöglicht die Bindung eines Protons sowie die Komplexbildung mit Metallen und Metallionen.
Stickstoffatome sind elektronegativer als Kohlenstoffatome, weshalb die Elektronendichte im Aromaten im Gegensatz zu Benzol verringert und zudem ungleich verteilt ist. Die höchste Elektronendichte befindet sich an den Stickstoffatomen. Im Vergleich zu Pyridin besitzen Diazine ein weiteres elektronenziehendes Stickstoffatom, wodurch die Elektronendichte im Aromaten noch geringer im Pyridin ist.[8][7] Aufgrund der Konkurrenz der beiden Stickstoffatome um die verfügbaren Elektronen weist Pyridazin eine geringere Basizität als Pyridin auf (pKs-Werte der konjugierten Säuren: Pyridin: 5,23, Pyridazin: 2,24).[8]
Darstellung
Nach der ursprünglich 1901 von R. Marquis[9] beschriebenen und 1942 durch Hückel und Jahnentz überarbeiteten Synthese[2] wird Furan mit einem Gemisch aus Salpetersäure und Acetanhydrid nitriert; das intermediär erhaltene Nitroacetofuran wird sofort weiter mit Hydrazinhydrat mit mäßiger Ausbeute von 20 % umgesetzt.

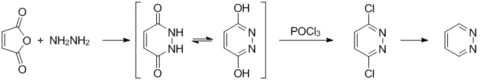
Bessere Ausbeuten werden erzielt bei der Umsetzung von Maleinsäurederivaten. So lässt sich Maleinsäureanhydrid erfolgreich einer Hydrazinolyse unterziehen. Das daraufhin entstehende 1,2-Dihydropyridazine-3,6-dion kann nach Chlorierung mit Phosphoroxychlorid mit H2-Pd/C mit bis zu 62 % Ausbeute zu Pyridazin umgesetzt werden.[10][11][12]
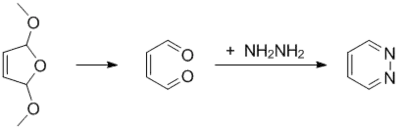
Die Reaktion von Maleindialdehyd mit Hydrazin führt ebenfalls zu Pyridazin. Aufgrund des labilen Charakters des Dialdehyds wird dieser zumeist in situ aus einem seiner korrespondierenden Diacetale freigesetzt.[13] Die Ausbeute dieser Methode konnte in einem Verfahren der BASF durch geringfügige Modifikationen der Originalvorschrift (insbesondere einer geänderten Reihenfolge der Arbeitsschritte) auf über 80 % gesteigert werden:[14]
Einzelnachweise
- Datenblatt Pyridazin bei Acros, abgerufen am 19. Februar 2010.
- Walter Hückel, Walter Jahnentz: Die Assoziation von Pyrazol und Pyridazin. In: Berichte der Deutschen Chemischen Gesellschaft. Band 75, Nr. 12, 1942, S. 1438–1446.
- Datenblatt Pyridazine bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- Raymond Nielson Castle: The Chemistry of Heterocyclic Compounds: Band 28 Pyridazines. John Wiley & Sons, 1973, ISBN 978-0-471-38213-3 (Seite 6 in der Google-Buchsuche).
- Robert Cooley Elderfield: Heterocyclic Compounds: Six-membered heterocycles containing two hetero atoms and their benzo derivatives. Wiley, 1957, S. 110.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- J. A. Joule, K. Mills: Heterocyclic Chemistry, S. 249–288, 5. Auflage, S. 7, Blackwell Publishing, Chichester, 2010, ISBN 1-4051-3300-7.
- D. T. Davies: Basistexte Chemie: Aromatische Heterocyclen, 1. Auflage, Wiley-VCH, Weinheim 1995, ISBN 3-527-29289-6, S. 73.
- R. Marquis: Compt. rend. Acad. Sciences 1901, 132: 140.
- R. H. Mizzoni und Paul. E. Spoerri: "Synthesis in the Pyridazine Series. I. Pyridazine and 3,6-Dichloropyridazine", Journal of the American Chemical Society 1951, 73: 1873–1874.
- C. M. Atkinson und C. J. Sharpe: "The Phenylation of Some Diazines.", Journal of the Chemical Society 1959: 3040–3046.
- Dong-bo Fan, Li-yan Dai, Xiao-zhong Wang und Ying-qi Chen: "Improved Synthesis Process of Pyridazine", Huaxue Shijie (Chemical World) 2007, 48(9): 549–552.
- A. Wohl und E. Bernreuther: "Über Derivate des Asparaginaldehyds. I.", Liebigs Annalen der Chemie 1930, 481: 1–29.
- M. Brüggemann und K. Ebel (BASF AG): "Verfahren zur Herstellung von Pyridazin", DE 102005029094 A1 2007.