Perchlorylfluorid
Perchlorylfluorid (FClO3) ist ein farbloses, giftiges Gas mit unangenehmem Geruch, welches leicht kondensierbar ist (Siedepunkt ca. −47 °C). Chemisch ist es das Säurefluorid der Perchlorsäure. Das Chlor liegt in seiner höchsten Oxidationsstufe +VII vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
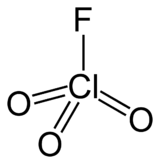 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Perchlorylfluorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | ClFO3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit süßlichem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 102,45 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
1,39 g·cm−3 [1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−46,8 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (0,6 g·l−1)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 3 ml·m−3 bzw. 13 mg·m−3[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Perchlorylfluorid kann durch Fluorierung von Kaliumchlorat mit Fluor in Antimonpentafluorid bei −20 °C oder durch Umsetzung von Kaliumperchlorat mit Fluorsulfonsäure erhalten werden[6]. Ebenfalls lässt es sich durch Reaktion von festen Alkalifluoriden (v. a. CsF) mit Dichlorheptoxid (Cl2O7) herstellen.
Ebenfalls möglich ist die Darstellung durch Reaktion von Kaliumperchlorat mit Fluorsulfonsäure[7]:
oder durch Umsetzung von Kaliumperchlorat mit Fluorwasserstoff und Antimon(V)-fluorid[8]:
Eigenschaften
Perchlorylfluorid ist bis über 400 °C beständig[6][9]. Es wirkt stark brandfördernd (oxidierend) und reagiert, v. a. beim Erhitzen, heftig mit Reduktionsmitteln. Auch viele Beschichtungsmittel, Kunststoffe und Gummi werden angegriffen. Mit Wasser reagiert es nur träge, abhängig vom pH-Wert, zu Perchlor- und Flusssäure.
Die Verbindung eignet sich zur Synthese von (zumeist explosionsfähigen) organischen Derivaten der Perchlorsäure. So können damit durch Reaktion mit Alkoholaten Perchlorsäureester hergestellt werden; mit Phenyllithium (C6H5Li) erhält man Perchlorylbenzol C6H5ClO3[10]. Mit reinem Natriummethylat erfolgt die Reaktion explosionsartig.[9] Mit Ammoniak und Aminen können sich Perchlorylamide R(R')N-ClO3 bilden, die bei unsubstituierten NH-Bindungen sauer wirken.[6]
Sicherheitshinweise
Bei Meerschweinchen führte die inhalative Gabe von 220 mg·m−3 Perchlorylfluorid zur Fibrose von Bindegewebe in der Lunge und Chronisch obstruktiver Lungenerkrankung sowie Verminderung der Anzahl von Erythrocyten und Erzeugung von Methämoglobin im Blut.[4]
Bei der Durchführung chemischer Reaktionen mit Perchlorylfluorid kam es in der Vergangenheit wiederholt zu unvorhergesehen Explosionen.[11] Adäquate Sicherheitsausrüstung ist deshalb unerlässlich.
Einzelnachweise
- Eintrag zu Perchlorylfluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Juli 2013. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7616-94-6 bzw. Perchlorylfluorid), abgerufen am 2. November 2015.
- Eintrag zu Trioxychlorofluoride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 12. August 2021.
- Spravochnik po Toksikologii i Gigienicheskim Normativam, Pg. 199, 1999.
- Pennsalt Chemicals Corp., Technical Div., New Products.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 491.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 180.
- C. A. Wamser et al.: Perchloryl fluoride. In: Aaron Wold and John K. Ruff (Hrsg.): Inorganic Syntheses. Band 14. McGraw-Hill Book Company, Inc., 1973, ISBN 07-071320-0 (defekt), S. 29–33 (englisch).
- L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Perchlorylfluorid, CD-ROM Ausgabe 4/2019, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4.
- Cotton-Wilkinson, Anorganische Chemie, 3. Auflage, Verlag Chemie 1974 ISBN 3-527-25503-6.
- Perchloryl fluoride: A further warning. In: Journal of Organometallic Chemistry. Band 91, Nr. 1, 20. Mai 1975, S. C20, doi:10.1016/S0022-328X(00)91886-2.

