Amatoxine
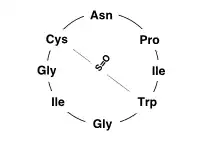
Bei den Amatoxinen handelt es sich um zyklische Oligopeptide, ringförmige Verbindungen aus acht Aminosäuren. Es gibt mindestens zehn Amatoxine, von denen α-Amanitin, β-Amanitin und γ-Amanitin die bekanntesten sind. Amatoxine kommen neben den ähnlich gebauten Phallotoxinen in einigen Arten der Gattung Wulstlinge (Amanita) vor, etwa in deren europäischen Vertretern Grüner Knollenblätterpilz (A. phalloides), Kegelhütiger Knollenblätterpilz (A. virosa) und Frühlingsknollenblätterpilz (A. verna). Auch verschiedene Pilzarten von Gattungen der Häublinge (Galerina), der Schirmlinge (Lepiota) und der Samthäubchen (Conocybe) enthalten Amatoxine.


Eigenschaften
Die Amatoxine sind resistent gegen Kochen und Trocknen; die aus acht Aminosäuren bestehenden Peptide werden auch durch die Proteasen im Magentrakt nicht zerlegt. Der Grund hierfür liegt im besonderen Bau dieser bizyklischen Oktapeptide.
Durch den Ringschluss der Oligopeptidkette sind es Cyclopeptide und eine besondere zusätzliche innere Querverknüpfung zwischen ihren Aminosäuren Tryptophan und Cystein macht sie zu einem bizyklischen Peptid. Diese Trp-Cys-Querbrücke als Sulfoxid ist ein charakteristisches Strukturmerkmal der Amatoxine und wesentlich für ihre extrem hohe Bindungsneigung an zentrale Regionen bestimmter RNA-Polymerasen,[2] die in tierischen Zellen für die Transkription nötig sind. Bei deren Blockade kommt die Proteinbiosynthese zum Erliegen. Die RNA-Polymerase der Pilzspezies selbst ist dagegen unempfindlich.
Eine ähnliche Verbrückung von Trp-Cys über ein Schwefelatom kennzeichnet – hier als Sulfid bzw. Thioether – ebenfalls die nahe verwandten bizyklischen Heptapeptide der Phallotoxine, welche mit hoher Affinität an F-Aktin binden. Solche Querbrücken durch eine zusätzliche interne Verknüpfung von Cystein und Tryptophan, auch Tryptathionin genannt, wurden bisher in anderen Naturprodukten nicht gefunden.[3]
Amatoxine, zu denen unter anderem die Amanitine gehören, enthalten ausschließlich L-Aminosäuren als Bausteine, davon einige hydroxyliert. Bei α-Amanitin sind dies neben Hydroxyprolin und 6-Hydroxytryptophan auch ein bishydroxyliertes Isoleucin – das (4R)-4,5-Dihydroxy-L-isoleucin wurde hier erstmals als Peptidbaustein entdeckt – sowie Isoleucin, Cystein, Glycin (zweimal) und Asparagin. An dessen Stelle liegt bei β-Amanitin Asparaginsäure vor, bei γ-Amanitin steht Hydroxyisoleucin anstelle von Dihydroxyisoleucin, bei ε-Amanitin ist beides der Fall. Die Struktur von δ-Aminitin ist nicht geklärt.
α-Amanitin hat die Summenformel C39H54N10O14S, eine molare Masse von 918,98 g/mol und die CAS-Nummer 23109-05-9.
β-Amanitin hat die Summenformel C39H53N9O15S, eine molare Masse von 919,97 g/mol und die CAS-Nummer 21150-22-1.
γ-Amanitin hat die Summenformel C39H54N10O13S, eine molare Masse von 902,98 g/mol und die CAS-Nummer 21150-23-2.
ε-Amanitin hat die Summenformel C39H53N9O14S, eine molare Masse von 903,97 g/mol und die CAS-Nummer 21705-02-2.
Alle vier sind kristallin, farblos, hitzestabil und löslich in Ethanol, Methanol und Wasser.
Strukturähnlichkeit
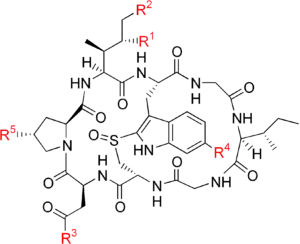
| Name | R1 | R2 | R3 | R4 | R5 |
|---|---|---|---|---|---|
| Amanin | OH | OH | OH | H | OH |
| Amaninamid | OH | OH | NH2 | H | OH |
| α-Amanitin | OH | OH | NH2 | OH | OH |
| β-Amanitin | OH | OH | OH | OH | OH |
| γ-Amanitin | H | OH | NH2 | OH | OH |
| ε-Amanitin | H | OH | OH | OH | OH |
| Amanullinsäure | H | H | OH | OH | OH |
| Amanullin | H | H | NH2 | OH | OH |
| Proamanullin | H | H | NH2 | OH | H |
 [4] [4] |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | LD50 (mg/kg) oral, Maus |
|---|---|---|---|---|---|---|---|---|---|
| Amanin | Dihyile | Trp | Gly | Ile | Gly | Cys | Asp | Hypro | 0,5 |
| Amaninamid | Dihyile | Trp | Gly | Ile | Gly | Cys | Asn | Hypro | 0,5 |
| α-Amanitin | Dihyile | Hytrp | Gly | Ile | Gly | Cys | Asn | Hypro | 0,3 |
| β-Amanitin | Dihyile | Hytrp | Gly | Ile | Gly | Cys | Asp | Hypro | 0,5 |
| γ-Amanitin | Hyile | Hytrp | Gly | Ile | Gly | Cys | Asn | Hypro | 0,2 |
| ε-Amanitin | Hyile | Hytrp | Gly | Ile | Gly | Cys | Asp | Hypro | 0,3 |
| Amanullinsäure | Ile | Hytrp | Gly | Ile | Gly | Cys | Asp | Hypro | > 20 |
| Amanullin | Ile | Hytrp | Gly | Ile | Gly | Cys | Asn | Hypro | > 20 |
| Proamanullin | Ile | Hytrp | Gly | Ile | Gly | Cys | Asn | Pro | > 20 |
Biosynthese
Kleine cyclische Peptide wie Amanitin werden in Pilzen gemeinhin als nichtribosomales Peptid von nichtribosomalen Peptidsynthetasen (NRPS) synthetisiert. Nachdem das Genom der nordamerikanischen Knollenblätterpilzart Amanita bisporigera vollständig sequenziert wurde, fanden sich aber keine für entsprechende NRPS codierenden Gene, was diese Möglichkeit hier ausschloss. Doch führte die Suche nach einer möglicherweise codierenden Sequenz, welche die in Amanitin enthaltenen Aminosäurenarten (Ile, Trp, Gly, Cys, Asn, Pro) auf acht Positionen in zutreffender Reihenfolge angibt, zu einem Abschnitt in einem Gen, welches AMA1 genannt wurde. Das von AMA1 codierte Proprotein allerdings ist mit 35 Aminosäuren wesentlich länger als das fertige Amanitin mit 8 AS, muss also posttranslational verkürzt werden durch eine Peptidase.[6] Weitergehende Untersuchungen ergaben, dass aus dem Polypeptid der Abschnitt mit der Aminosäuresequenz IWGIGCNP in einem ersten Schritt von einer Prolyl-Oligopeptidase (POP) herausgeschnitten wird.[7] Die weitere Verarbeitung – welche unter anderem eine Cyclisierung des Peptides, dessen innere Verbrückung und die Hydroxylierung einzelner Aminosäuren beinhaltet – ist im Einzelnen noch nicht bekannt.
Toxizität
Amatoxine hemmen die Transkription durch Blockade von RNA-Polymerasen.[1] Dieser Mechanismus ist selektiv und setzt an spezifischen Strukturmerkmalen der RNA-Polymerasen an; so werden solche der Amanita-Pilzarten selbst nicht betroffen, hingegen insbesondere die RNA-Polymerase II von Säugetierarten. Deren Blockade führt dann wegen der ausfallenden mRNA-Synthese dazu, dass aus dem Zellkern keine genetische Information mehr in das Zellplasma gelangen kann, wo die Proteinbiosynthese (als Translation) stattfindet.
Die verschiedenen RNA-Polymerasen von Säugetierzellen sind unterschiedlich empfindlich für Amanitin. Sehr stark betroffen ist die RNA-Polymerase II,[1] die unter anderem für die mRNA-Synthese nötig ist. Die RNA-Polymerase III, für die tRNA-Synthese erforderlich, wird deutlich schwächer gehemmt, und die RNA-Polymerase I, die für die rRNA-Synthese gebraucht wird, ist nicht betroffen. Wegen der mannigfaltigen Funktionen der unterschiedlichen, nach Vorlage einer mRNA gebildeten Proteine sind zahlreiche Prozesse des Organismus betroffen:
- Enzyme werden nicht mehr gebildet, die von ihnen katalysierten Stoffwechselprozesse kommen zum Erliegen.
- Strukturproteine werden bei Alterung nicht mehr ersetzt.
- Hormone (sowohl Peptid- als auch die enzymatisch gebildeten Hormone) tragen nicht mehr zur Steuerung von Stoffwechselvorgängen bei.
- Membranrezeptoren, beispielsweise an Nervenzellen, werden nicht nachgebildet.
Die Effekte zeigen sich bei einer Vergiftung durch Knollenblätterpilze zunächst als Durchfall, welcher durch die Schädigung der Epithelzellen des Darmes ausgelöst wird. Erst später – nach Aufnahme der Toxine ins Blut, deren Verteilung im Körper, ihrer Aufnahme in Zellen und der Bindung an RNA-Polymerase-Komplexe im Zellkern – treten weitere Symptome auf, denen irreversible Zellschädigungen zugrunde liegen. Bei hinreichend hoher Dosis kann es auch zu einem Leberversagen kommen, das tödlich endet. Die toxische Wirkung der Amanitine wird durch ihren enterohepatischen Kreislauf verstärkt; das Amanitin zirkuliert zwischen Leber, Gallenblase und Darm und verbleibt so länger im Körper.
Gegenmittel
Das einzige bekannte Gegenmittel ist Silibinin.[9]
Anwendungen
Viele Tumoren haben das Gen für den Tumorsuppressor p53 verloren, wobei oftmals eine daran angrenzende Genkopie für die größte und katalytisch aktive Untereinheit der RNA-Polymerase II (POLR2A) ebenfalls verloren geht.[10] Die Hemmung der RNA-Polymerase II mit α-Amanitin wird daher zur Behandlung von p53-negativen Tumoren untersucht, da die Tumorzellen stärker unter der Hemmung leiden als gesunde Zellen.[10]
Geschichte
Nachdem Feodor Lynen und Ulrich Wieland bereits 1937 ein Knollenblätterpilzgift, das Phallotoxin Phalloidin, kristallin darstellen konnten, wurden Amatoxine erstmals 1941 von Heinrich Wieland und Rudolf Hallermayer als „Amanitin“ genannter Giftstoff des Knollenblätterpilzes isoliert.[11] Die einzelnen Komponenten des Toxingemischs wurden später von Theodor Wieland und Mitarbeitern als α-, β- und γ-Amanitin unterschieden und 1966 ihrer Struktur nach aufgeklärt.[12]
Literatur
- Eintrag zu Amanitine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juni 2014.
- Theodor Wieland: Amatoxine, Phallotoxine – die Gifte des Knollenblätterpilzes. In: Chemie in unserer Zeit, 13. Jahrg. 1979, Nr. 2, S. 56–63.
Einzelnachweise
- J. Vetter: Toxins of Amanita phalloides. In: Toxicon: official journal of the International Society on Toxinology. Band 36, Nummer 1, Januar 1998, S. 13–24, PMID 9604278.
- J. May, D. Perrin: Tryptathionine bridges in peptide synthesis. In: Biopolymers. 88, Nr. 5, 2007, S. 714–724. PMID 17626299.
- Jonathan Walton, Heather Hallen-Adams, Hong Luo: Ribosomal Biosynthesis of the Cyclic Peptide Toxins of Amanita Mushrooms. In: Biopolymers, Band 94, Nummer 5, 2010, S. 659–664, PMC 4001729 (freier Volltext).
- David G. Spoerke, Barry H. Rumack: Handbook of mushroom poisoning: diagnosis and treatment. CRC Press, 1994. ISBN 0-8493-0194-7, S. 167 ff.
- UniProt P85421 (α-, γ-Amanitin).
- Heather E. Hallen: Gene family encoding the major toxins of lethal Amanita mushrooms. In: Proceedings of the National Academy of Sciences, Vol. 104, 2007, no. 48.
- H. Luo, H. E. Hallen-Adams, J. D. Walton: Processing of the phalloidin proprotein by prolyl oligopeptidase from the mushroom Conocybe albipes. In: The Journal of biological chemistry. Band 284, Nummer 27, Juli 2009, S. 18070–18077, doi:10.1074/jbc.M109.006460, PMID 19389704, PMC 2709354 (freier Volltext).
- F. Brueckner, P. Cramer: Structural basis of transcription inhibition by alpha-amanitin and implications for RNA polymerase II translocation. In: Nature Structural & Molecular Biology. Band 15, August 2008, S. 811–818, PMID 18552824.
- Th. Zilker, JJ Kleber, B. Haber: Amatoxinsyndrom. toxinfo.org, 2000
- Yunhua Liu, Xinna Zhang, Cecil Han, Guohui Wan, Xingxu Huang, Cristina Ivan, Dahai Jiang, Cristian Rodriguez-Aguayo, Gabriel Lopez-Berestein, Pulivarthi H. Rao, Dipen M. Maru, Andreas Pahl, Xiaoming He, Anil K. Sood, Lee M. Ellis, Jan Anderl, Xiongbin Lu: TP53 loss creates therapeutic vulnerability incolorectal cancer. In: Nature. 520, 2015, S. 697, doi:10.1038/nature14418.
- H. Wieland, R. Hallermayer: Über die Giftstoffe des Knollenblätterpilzes. VI. Amanitin, das Hauptgift des Knollenblätterpilzes. In: Justus Liebigs Annalen der Chemie. Band 348, Nr. 1, Mai 1941, S. 1–18. doi:10.1002/jlac.19415480102.
- T. Wieland, U. Gebert: Über die Inhaltsstoffe des grünen Knollenblätterpilzes, XXX. Strukturen der Amanitine. In: Justus Liebigs Annalen der Chemie. Band 700, Nr. 1, Januar 1967, S. 157–173. doi:10.1002/jlac.19667000119.