Mikrotubulus
Mikrotubuli sind röhrenförmige Proteinkomplexe, die zusammen mit den Mikrofilamenten und den Intermediärfilamenten das Cytoskelett eukaryotischer Zellen bilden. Sie sind mitverantwortlich einerseits für die mechanische Stabilisierung der Zelle und ihrer Form, andererseits im Zusammenspiel mit anderen Proteinen für Bewegungen und Transporte innerhalb der Zelle sowie für aktive Bewegungen der ganzen Zelle.

| Übergeordnet |
| Zytoskelett |
| Gene Ontology |
|---|
| QuickGO |
Aufbau
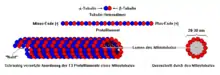
Mikrotubuli sind gerichtete Strukturen, deren Enden wegen ihrer Polymerisationsrichtung mit plus und minus bezeichnet werden. Sie bestehen aus Einheiten, die sich ihrerseits als Heterodimere ohne kovalente Bindung aus je einem Molekül α-Tubulin (negativ) und β-Tubulin (positiv) zusammensetzen. Die Einheiten bilden durch längsgerichtete Verknüpfung Subfilamente (sogenannte Protofilamente), von denen meist 13 in seitlicher Verknüpfung die Wand der Mikrotubuli bilden. In der Zelle sind Mikrotubuli typischerweise mit ihrem minus-Ende (über das α-Tubulin) an ein Mikrotubulus-Organisationszentrum (MTOC) gebunden, welches γ-Tubulin enthält. Die Tubuline verschiedener Organismen sind nicht identisch. Dadurch variieren die Durchmesser der Mikrotubuli zwischen 20 und 30 Nanometer.
Die Reihenfolge und genaue Zusammensetzung von Molekülen während der Bildung von Mikrotubuli kann demnach folgendermaßen zusammengefasst werden: Ein β-Tubulin verbindet sich im Rahmen einer nicht vorhandenen kovalenten Bindung mit einem α-Tubulin, welche in verbundener Form ein Heterodimer sind, da sie aus zwei verschiedenen Polypeptiden bestehen (aus dem β-Tubulin und α-Tubulin). Nachdem also die Heterodimere geformt sind, verbinden Sie sich zu langen Ketten, die bildhaft in eine Richtung (z. B. nach oben) aufsteigen. Diese Heterodimere, welche in einer bestimmten Richtung verbunden sind, formen Protofilamente. Diese langen Ketten (Protofilamente), lagern sich nun nach und nach nebeneinander an, sodass eine rohrartige Struktur entsteht, welche rohrtypisch ein Lumen besitzt. Demnach formen meist 13 Protofilamente die Außenwand der Mikrotubuli. Wichtig ist außerdem, dass die Heterodimere aus einem positiven und negativen Ende bestehen, wobei das Alpha-Tubulin das negative Ende und das Beta-Tubulin das positive Ende formen. Aufgrund der Tatsache, dass die Heterodimere aufeinandergestapelt werden, ergibt sich immer ein negatives und positives Ende. Mikrotubuli wachsen durch eine Addition von Heterodimeren am Plus-Ende.
Mikrotubuli sind relativ vergängliche Strukturen mit einer mittleren Lebensdauer in der Größenordnung von 10 Minuten, sofern sie nicht durch Einbau in größere Strukturen stabilisiert sind. Im Cytoplasma der Zellen liegt in der Regel ein Gleichgewicht zwischen polymerisiertem und depolymerisiertem Tubulin vor. Die Tubulin-Einheiten werden ständig sowohl am plus- als auch am minus-Ende des Mikrotubulus angebaut und auch wieder depolymerisiert, so dass ein Gleichgewicht entsteht, wobei beide Prozesse am plus-Ende schneller verlaufen. Dabei wächst das Tubusende kontinuierlich und zerfällt immer wieder plötzlich über eine längere Strecke (siehe dynamische Instabilität). Kippt das Gleichgewicht, kann es zur völligen Auflösung der Mikrotubuli kommen. Auch das Gegenteil, die Erschöpfung des Vorrats an Tubulineinheiten, ist möglich. Niedrige Temperatur und ein Überschuss an Calcium-Ionen fördern die Depolymerisation der Mikrotubuli. Das dynamische Netzwerk von Mikrotubuli-Filamenten in der Zelle entspringt am microtubule organizing center (MTOC). Der Auf- und Abbau von Mikrotubuli kann durch Zytoskelett-Inhibitoren gehemmt werden.
Organisation
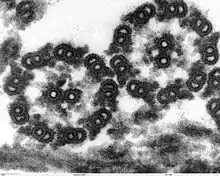
Mit den Mikrotubuli sind zahlreiche Proteine assoziiert, sogenannte MAPs (microtubule associated proteins). Die bekanntesten sind Motorproteine wie Dynein und Kinesin. Einige MAPs können anscheinend Mikrotubuli stabilisieren. MAPs können Mikrotubuli zu größeren Strukturen verbinden. Zu nennen sind hier insbesondere die Axoneme, Achsfäden beweglicher Zellanhänge: der motilen Zilien und der eukariotischen Flagellen (Geißeln). Ein Axonem ist ein Bündel, in dem neun Doppeltubuli zwei einzelne im Zentrum umgeben; man spricht von einer (9×2 + 2)-Struktur (siehe Abbildung). Die Doppeltubuli haben einen asymmetrischen Querschnitt, in dem ein vollständiger „A-Tubus“ mit einem unvollständigen „B-Tubus“ verschmilzt.
Eine andere Organisationseinheit bilden Zentriolen; das sind Röhrchen nach dem (9×3 + 0)-Muster. Einzeln fungieren sie als Basalkörper von Zilien und Geißeln. In tierischen Zellen bildet ein rechtwinklig verbundenes Paar von Zentriolen mit einer umgebenden Matrix, die γ-Tubulin enthält, das Zentralkörperchen, Zentrosom, MTOC, das sich meist nahe dem Zentrum der Zelle findet und von dem einige hundert Mikrotubuli in alle Richtungen sternförmig auswachsen. Erreichen sie die Rindenschicht der Zelle, den sogenannten Zellkortex, so können sie, indem sie dort mit anderen Elementen des Zytoskeletts Kontakt aufnehmen, helfen, die Gestalt der Zelle zu stabilisieren. Das Zentrosom wird vor der Zellteilung verdoppelt, und die zwei Zentrosomen bilden jetzt die Pole des Spindelapparats, der wiederum aus Mikrotubuli besteht und dessen Aufgabe es ist, die Chromosomen auf die Tochterzellen zu verteilen.
Funktion
Abgesehen vom ständigen Auf- und Abbau an den Enden sind Mikrotubuli steif und unveränderlich. Dennoch haben sie nicht nur Stützfunktionen in der Zelle. Motorproteine, die sich (vorstellbar etwa wie Spannerraupen) an den Mikrotubuli unter ATP-Verbrauch entlanghangeln, tragen Vesikel und Granulae durch die Zelle. Kinesine transportieren meist in Richtung Plus-Ende, Dyneine in Richtung Minus-Ende. Vor der Zellteilung bilden Mikrotubuli den Spindelapparat, über welchen die Chromatiden zu den Polen der Zelle (Minus-Enden der Mikrotubuli) gezogen werden. In Nervenzellen wandern mit Neurotransmittern gefüllte Vesikel vom Zellkörper zu den Synapsen in Plusrichtung, siehe axonaler Transport.
Eine andere Art von Bewegung erzeugen Zilien und Geißeln. Die oben beschriebenen Axoneme enthalten unter anderem Dynein. Indem das Dynein die Mikrotubuli gegeneinander verspannt, krümmt es das Axonem (Auch hierfür wird ATP verbraucht). Zilien können durch in Phase und Richtung koordinierten Flimmerschlag Strömung erzeugen, siehe Wimpertierchen, oder Material in einem Lumen transportieren, siehe Flimmerepithel. Geißeln bewegen einzelne Zellen fort (z. B. Spermien), indem sie hin und her schlagen. Den (9×2 + 2)-Bauplan der Axoneme hat die Evolution vom primitiven Einzeller bis zum Menschen beibehalten. Auch der (9×2 + 0)-Bauplan tritt häufig auf. Zilien dieses Typs sind meist unbeweglich. Sie bilden spezialisierte Zellkompartimente – z. B. das Außensegment bei ziliären Photorezeptorzellen, die Chemorezeptoren der Riechzellen oder Strömungsdetektoren in Flüssigkeiten.
Bedeutung in der Krebsbekämpfung
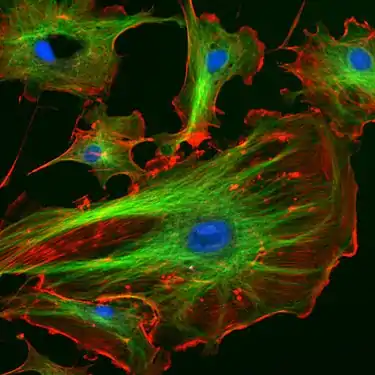
Starke Bedeutung kommt den Mikrotubuli bei der Bekämpfung von Krebs zu. Substanzen, die das dynamische Gleichgewicht des Auf- und Abbaus der Mikrotubuli stören, behindern insbesondere die korrekte Ausbildung und Funktion des Spindelapparats und wirken dadurch als Mitosegifte, d. h., sie verhindern die korrekte Zellteilung und damit das Wachstum von Tumoren und Metastasen. Einige werden als Zytostatika im Rahmen der Chemotherapie genutzt. Alkaloide aus der Rosafarbenen Catharanthe (Catharanthus roseus, früher Vinca roseus), das Vincristin und das Vinblastin, fällen Tubulin aus. Paclitaxel (Taxol), ein Alkaloid aus der Pazifischen Eibe (Taxus brevifolia), und das Epothilon aus dem Myxobakterium Sorangium cellulosum stabilisieren Mikrotubuli und hindern sie am Depolymerisieren.
Die Zytostatika wirken allerdings auch in anderen Geweben bzw. Organen, in denen sich Zellen teilen. Das sind z. B. Oberhaut, Haarfollikel, das Knochenmark als Bildungsstätte von Immun- und Blutzellen, die Leber und die Keimdrüsen. Dementsprechend haben Zytostatika viele erhebliche Nebenwirkungen wie Haarausfall, Darmbluten oder erhöhte Infektionsanfälligkeit.
Bedeutung für die Pflanzenzüchtung
Colchicin, ein Alkaloid aus der Herbstzeitlose (Colchicum autumnale), hemmt die Polymerisation der Mikrotubuli, indem es die Tubulineinheiten bindet und dem Kreislauf entzieht. Durch gezielte Behinderung der Meiose ließ es sich erfolgreich zur Züchtung polyploider Pflanzen einsetzen. Bei tierischen Organismen gilt Colchicin als keimgutschädigend.
Quantenphysik und Bewusstsein
Stuart Hameroff und Roger Penrose haben gemeinsam die Hypothese aufgestellt, dass bewusstseinsbildende Gehirnfunktionen auf makroskopischen Quanteneffekten beruhen, die sich in den Mikrotubuli des Zellskeletts abspielen. Bei höheren Evolutionsstufen seien es die Mikrotubuli der Hirnneuronen, aber im Prinzip gelte dieser fast panpsychische Mechanismus sogar für Einzeller mit Zytoskelett.[1][2]
Literatur
- Klaus Werner Wolf, Konrad Joachim Böhm: Organisation von Mikrotubuli in der Zelle. In: Biologie in unserer Zeit. 27, 2, 1997, ISSN 0045-205X, S. 87–95.
- James R Davenport, Bradley K Yoder: An incredible decade for the primary cilium: a look at a once-forgotten organelle. In: Am J Physiol Renal Physiol. 289, Nr. 6, 2005, S. F1159-1169. doi:10.1152/ajprenal.00118.2005. PMID 16275743.
Referenzen, Anmerkungen
- S. Hameroff: How quantum brain biology can rescue conscious free will. In: Frontiers in integrative neuroscience. Band 6, 2012, S. 93, doi:10.3389/fnint.2012.00093, PMID 23091452, PMC 3470100 (freier Volltext).
- S. Hameroff, R. Penrose: Consciousness in the universe: a review of the 'Orch OR' theory. In: Physics of life reviews. Band 11, Nummer 1, März 2014, S. 39–78, doi:10.1016/j.plrev.2013.08.002, PMID 24070914 (Review).