Glykogenolyse
Unter der Glykogenolyse (Synonym: Glykogenabbau) versteht man den physiologischen Abbau von Glykogen zu Glucose-1-phosphat und Glucose.
| Übergeordnet |
| Glykogen-Metabolismus Abbau der Glucane |
| Gene Ontology |
|---|
| QuickGO |
Der umgekehrte Prozess ist die Glykogensynthese.
Physiologie
Die Glykogenolyse dient dem temporären Ausgleich fehlender Nahrungsglukose. Die Muskeln nutzen das in ihnen gespeicherte Glykogen selbst, die Leber kann durch die Glykogenolyse auch anderen Organen Glucose zur Verfügung stellen.
Auslöser für die Glykogenolyse ist ein vermehrter Energiebedarf des Körpers, und die damit verbundene Ausschüttung der Hormone Glukagon und Adrenalin. Das Hormon Insulin hemmt hingegen die Glykogenolyse.
Biochemie
Glykogen ist ein Molekül in dem baumartig Glucose-Moleküle glycosidisch miteinander verbunden sind (siehe schematische Abbildung). Dabei werden längere lineare Ketten von Glucose-Molekülen (gelbe Kreise in der Abbildung) durch alpha-1,4-glykosidische Bindungen gebildet, während die Y-förmige Verzweigstellen (grüne Kreise in der Abbildung) durch alpha-1,6-glykosidische Bindungen gebildet werden.
Das Hormon Glukagon führt in der Leberzelle zu einem Abbau von Glykogen. Dazu wird von der Leberzelle cAMP aktiviert sowie die Enzyme Glykogenphosphorylase und das sogenannte Glykogen-Debranching-Enzym gesteigert produziert.
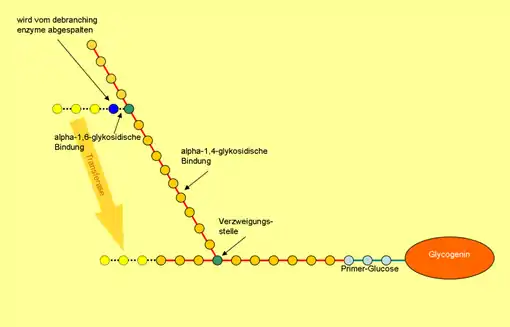
Der lineare Anteil des Glykogens mit den alpha-1,4-glykosidische Bindungen wird durch die Glykogenphosphorylase abgebaut. Dort katalysiert das Enzym Glykogenphosphorylase die Bindung freien Phosphats am C1-Atom der Glucose. Die glykosidische Bindung zwischen den Glucose-Molekülen wird dadurch aufgespalten. Als Produkt entsteht Glucose-1-phosphat, welches dann noch zur intrazellulären und verwertbaren Form, dem Glucose-6-phosphat, umgebaut (isomerisiert) wird.
Die Glykogenphosphorylase kann das Glykogen allerdings nur bis zum vierten Glucose-Molekül vor der nächsten Verzweigungsstelle abbauen. Um den weiteren Abbau zu ermöglichen, entfernt die Transferasedomäne des Glykogen-Debranching-Enzym drei der vier Glukose-Moleküle vor der Verzweigungsstelle (hell-gelbe Kreise in der Abbildung) und fügt sie an einer anderen Seitenkette linear (also alpha-1,4-glykosydisch gebunden) an. Die Glucose-Moleküle dieser Seitenkette können nun wieder einzeln durch die Glykogenphosphorylase abgespalten werden.
Das verbleibende Glucose-Molekül, das alpha-1,6-glykosidisch gebunden ist (blauer Kreis in der Abbildung), wird vom Glucosidaseteil des Glykogen-Debranching-Enzym abgespalten. Dabei entsteht kein Glucose-1-Phosphat, sondern freie Glucose. So führt die Verzweigung des Glykogens dazu, dass bei der Glykogenolyse zu etwa 90 % Glucose-1-Phosphat entsteht, und nur etwa 10 % freie Glucose.
Regulation des Glykogenmetabolismus
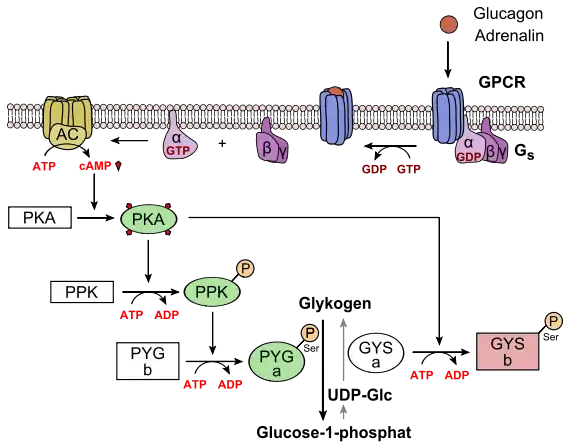
Adrenalin (Muskel) oder Glucagon (Leber) aktivieren einen G-Protein gekoppelten Rezeptor (GPCR), an der ein Gs-Protein angedockt ist. Dessen α-Untereinheit hat GDP gebunden, welches nach Aktivierung des GPCR mit GTP ausgetauscht wird. Dadurch wird die α-Untereinheit vom Rezeptor freigesetzt und aktiviert eine Adenylylcyclase (AC). Das dabei gebildete cAMP aktiviert eine Proteinkinase A (PKA), die wiederum die Phosphorylierung einer Phosphorylase-Kinase (PPK) katalysiert. Die dadurch stimulierte Kinase aktiviert katalytisch eine Glycogenphosphorylase (PYG), welche den Abbau von Glykogen zu Glucose-1-phosphat katalysiert. Proteinkinase A phosphoryliert gleichzeitig eine UDP-Glykogensynthase (GYS), welche dadurch inaktiviert wird und die Umkehrreaktion nicht mehr katalysieren kann.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage, Spektrum Akademischer Verlag, Heidelberg 2007. ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage, John Wiley & Sons, New York 2004. ISBN 0-471-19350-X.
- Bruce Alberts, Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell, 5. Auflage, Taylor & Francis 2007, ISBN 978-0815341062.
Weblinks
| Dieser Text basiert ganz oder teilweise auf dem Eintrag Glykogenolyse im Flexikon, einem Wiki der Firma DocCheck. Die Übernahme erfolgte am 5. März 2008 unter der damals gültigen GNU-Lizenz für freie Dokumentation. |