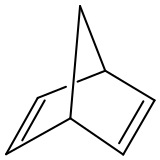
Norbornadien
Norbornadien ist ein bicyclischer Kohlenwasserstoff, der als potentieller Kandidat zur Speicherung von Sonnenenergie im Gespräch ist. Es ist auch als Metallligand von Interesse, die in der homogenen Katalyse Verwendung finden. Norbornadien ist auch ein nützliches Dienophil in der Diels-Alder-Reaktion. Verwandte bicyclische Verbindungen sind Norbornen, welches dasselbe Kohlenstoffgerüst, aber nur eine Doppelbindung besitzt, und Norbornan, ebenfalls mit demselben Gerüst, aber ohne Doppelbindungen und somit gesättigt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Norbornadien | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H8 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, unangenehm penetrant riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 92,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,470 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Synthese
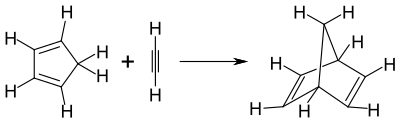
Norbornadien kann durch eine Diels-Alder-Reaktion von Cyclopentadien und Acetylen hergestellt werden. Die Umsetzung verläuft mit einer Reaktionswärme von −117 kJ·mol−1 exotherm.[4]
Eigenschaften
Norbornadien bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei etwa −11 °C.[2] Der Explosionsbereich liegt zwischen 1 Vol.‑% (38 g/m3) als untere Explosionsgrenze (UEG) und 6,3 Vol.‑% als obere Explosionsgrenze (OEG).[1][2] Die Zündtemperatur beträgt 350 °C.[2] Der Stoff fällt somit in die Temperaturklasse T2.
Speicherung von Sonnenenergie
Quadricyclan, ein Valenzisomer, kann durch eine photochemische Isomerisierung in Gegenwart eines Sensibilisierers wie z. B. Michlers Keton oder Acetophenon erhalten werden.[5]
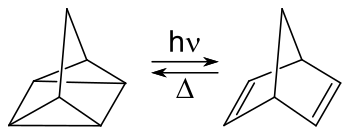
Reaktion von Norbornadien zu Quadricyclan:
Hinreaktion durch Energiezufuhr aus UV-Licht hν und Rückreaktion durch Temperaturerhöhung Δ
Dieses Isomerenpaar ist von potentiellem Interesse zur Speicherung von Solarenergie, wenn die Rückreaktion durch eine kontrollierte Führung möglich wird. Die theoretisch speicherbare Energie beträgt −89 kJ/mol.[6][7][8] Da die Hauptabsorption dieser Reaktion bei rund 300 nm liegt, aber nur ein geringer Anteile des Sonnenlichts unter 400 nm, ist dieser Einsatz aber begrenzt.
Reaktionen
Norbornadien ist ein reaktives Reagenz bei Cycloadditionen und auch ein Startmaterial für die Herstellung von Diamantan[9] und Sumanen. Es wird auch als Acetylenübertrager bei Reaktionen mit Tetrazinen, wie zum Beispiel 3,6-Di-2-pyridyl-1,2,4,5-tetrazin, verwendet.[10]
Verwendung als Ligand
Norbornadien ist ein vielseitiger Ligand in der metallorganischen Chemie, wo es als Zwei- oder Vier-Elektronendonator fungiert.[11]
Ein Beispiel hierfür ist das Tetracarbonyl(norbornadien)chrom(0).[12]
Literatur
- Beyer / Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 390.
- Streitwieser / Heathcock: Organische Chemie, 1. Auflage, Verlag Chemie, Weinheim 1980, ISBN 3-527-25810-8, S. 1351–1352.
Weblinks
Einzelnachweise
- Eintrag zu Norborna-2,5-dien. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. November 2017.
- Eintrag zu Bicycloheptadien in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. November 2017. (JavaScript erforderlich)
- Datenblatt Bicyclo[2.2.1]hepta-2,5-diene, 98% bei Sigma-Aldrich, abgerufen am 13. März 2014 (PDF).
- Walsh, R.; Wells, J.M.: The enthalpy of formation of bicyclo[2,2,1]hepta-2,5-diene. Thermodynamic functions of bicyclo[2,2,1]heptane and bicyclo[2,2,1]hepta-2,5-diene in J. Chem. Thermodyn. 7 (1975) 149–154, doi:10.1016/0021-9614(75)90262-1.
- Claibourne D. Smith: Quadricyclane In: Organic Syntheses. 51, 1971, S. 133, doi:10.15227/orgsyn.051.0133; Coll. Vol. 6, 1988, S. 962 (PDF).
- A. D. Dubonosov, Vladimir A. Bren, V. A. Chernoivanov: Norbornadiene – quadricyclane as an abiotic system for the storage of solar energy. In: Russian Chemical Reviews 71 (2002): 917–927.
- Gregory W. Sluggett, Nicholas J. Turro, Heinz D. Roth: Rh(III)-Photosensitized Interconversion of Norbornadiene and Quadricyclane. In: J. Phys. Chem. A. 101, Nr. 47, 1997, S. 8834–8838. doi:10.1021/jp972007h.
- Constantine Philippopoulos, Dimitrios Economou, Constantine Economou, John Marangozis: Norbornadiene-Quadricyclane System in the Photochemical Conversion and Storage of Solar Energy. In: Ind. Eng. Chem. Res.. 22, Nr. 4, 1983, S. 627. doi:10.1021/i300012a021.
- Tamara M. Gund, Wilfried Thielecke, Paul v. R. Schleyer: Diamantane In: Organic Syntheses. 53, 1973, S. 30, doi:10.15227/orgsyn.053.0030; Coll. Vol. 6, 1988, S. 378 (PDF).
- Ronald N. Warrener, Peter A. Harrison: π-Bond Screening in Benzonorbornadienes: The Role of 7-Substituents in Governing the Facial Selectivity for the Diels-Alder Reaction of Benzonorbornadienes with 3,6-Di(2-pyridyl)-s-Tetrazine. In: Molecules. 6, Nr. 4, 2001, S. 353–369. doi:10.3390/60400353.
- Ryo Shintani, Tamio Hayashi: Chiral Diene Ligands for Asymmetric Catalysis, Aldrichimica Acta, 2009, vol. 42, number 2, S. 31–38.
- Markus Strotmann, Rudolf Wartchow, Holger Butenschön: High yield synthesis and structures of some achiral and chiral (diphosphine)tetracarbonylchromium(0) chelate complexes with tetracarbonyl(norbornadiene)chromium(0) as complexation reagent. In: Arkivoc. 2004, S. KK–1112F.