Reziproke Proportionalität
Reziproke Proportionalität,[1] indirekte Proportionalität, umgekehrte Proportionalität[2] oder Antiproportionalität besteht zwischen zwei Größen, wenn sich eine proportional zum Kehrwert der anderen verhält, oder gleichbedeutend, das Produkt der Größen konstant (unveränderlich) ist. Die eine Größe ist dann eine reziprok proportionale (auch antiproportionale) Funktion der anderen Größe. Die Verdopplung (Verdreifachung, Halbierung, …) der einen ist mit einer Halbierung (Drittelung, Verdopplung, …) der anderen verbunden. Der Funktionsgraph ist eine Hyperbel, die sich den Koordinatenachsen asymptotisch annähert.
Reziproke Zusammenhänge
Das konstante Produkt zweier Größen und sei bekannt aus einem Wertepaar
(, ). Danach lässt sich die eine Größe als Funktion der anderen angeben:
- .
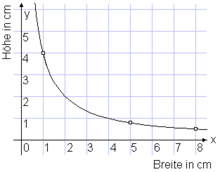
Beispiel: Gegeben ist ein Rechteck, 8 cm breit und 0,5 cm hoch. Gesucht ist ein flächengleiches Rechteck der Breite 5 cm.
Das konstante Produkt ist 8 cm · 0,5 cm = 4 cm2.
Die gesuchte Höhe ist 4 cm2/(5 cm) = 0,8 cm.
Nebenstehendes Diagramm zeigt die beiden Wertepaare als markierte Punkte. An der Hyperbel kann man weitere flächengleiche Rechtecke ablesen, z. B. 1 cm breit, 4 cm hoch.
Als weitere reziproke Zusammenhänge seien genannt:
- Die Durchschnittsgeschwindigkeit ist umgekehrt proportional zur Fahrtdauer.
- Nach dem Ohmschen Gesetz ist die elektrische Stromstärke umgekehrt proportional zum Widerstand.
- Nach dem Gesetz von Boyle-Mariotte ist der Druck eines idealen Gases umgekehrt proportional zu seinem Volumen.
Reziproke Darstellung
Die Darstellung reziproker Zusammenhänge in einem kartesischen Koordinatensystem verwendet vielfach eine Achsenbeschriftung, bei der in einer linearen Teilung nicht der Zahlenwert einer darzustellenden Größe aufgetragen wird, sondern der Kehrwert ihres Zahlenwerts. Eine solche Darstellung ist vor allem dann hilfreich, wenn eine Proportionalität zwischen der abhängigen und dem Kehrwert der unabhängigen Variablen besteht. Dadurch entsteht in einem Liniendiagramm ein geradliniger Verlauf.
Als Beispiel sollen Vorgänge der chemischen Kinetik erster Ordnung dienen, deren Geschwindigkeitskonstante von der Temperatur abhängig ist, gemäß der Arrhenius-Gleichung
mit
Reaktionsgeschwindigkeitskonstante Eulersche Zahl Aktivierungsenergie universelle Gaskonstante absolute Temperatur
Die Gleichung lässt sich umschreiben in
.
Ob ein Prozess tatsächlich gemäß der Arrhenius-Gleichung als Reaktion erster Ordnung abläuft, ist daran zu erkennen, dass in einer Darstellung, in der über mit linearen Teilungen aufgetragen wird, eine Gerade entsteht, siehe Arrheniusgraph. Die Aktivierungsenergie ergibt sich bei dieser Geraden aus ihrem Anstieg .
Schreibweise
Für „a ist umgekehrt proportional zu b“ schreibt man mit einem der beiden Proportionalitätszeichen kurz:
- oder
Weblinks
Einzelnachweise
- So im Bronstein benannt
- Das große Tafelwerk interaktiv. ISBN 978-3-464-57143-9