Extremitätenevolution
Als Evolution der Extremitäten wird die Umwandlung der paarigen Flossen der Knochenfische (Osteichthyes) zu den Vorder- und Hintergliedmaßen der Landwirbeltiere (Tetrapoda) im Verlauf der Stammesgeschichte bezeichnet sowie der anschließende evolutionäre Formenwandel der Gliedmaßen nach dem Landgang der Wirbeltiere.
Einführung
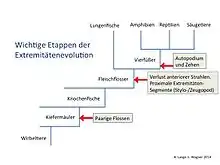
Die Evolution von Körperanhängen zur Erreichung der Beweglichkeit war eine wichtige Innovation im Ordovizium. Diese Innovation trat zuerst bei kieferlosen Wirbeltieren mit je einer schmalen, langen, streifenförmigen Flosse an Rücken und Bauch auf. Bei anderen entstanden paarige Brustflossen direkt hinter dem Kopf. Das Auftreten paariger Flossen ist eine Synapomorphie, d. h. eine neue Eigenschaft der Kiefermäuler (Gnathostomata).[1] Vergleichende Entwicklungsanalysen von Genen, die für die Musterbildung der Tetrapodenextremität verantwortlich sind, zeigen, dass sie in paarigen Fischflossen angeordnet sind. Unabhängig einer tiefen Homologie der Basisstrukturen und der unterliegenden Entwicklungsprozesse und Genetik bleiben heute Fragen bei den komplizierten phänotypischen Umbauten der distalen skelettären Fischflossenpartien zu distalen Elementen der Tetrapodenextremität (Hand/Fuß) offen.[1] Bestimmte Skelettelemente mussten evolutionär verschwinden, während andere, distale, neu hinzukamen. Die Transformation von Flossen zu Tetrapoden-Extremitäten war eine der bedeutendsten makroevolutionären Variationen in der Geschichte der Wirbeltiere.[1]
Bauformen
Die paarigen Flossen von Fischen und Extremitäten von Tetrapoden sind insofern homologe Skelettelemente, als sie bei beiden an Schulter- und Beckengürtel ansetzen und die Extremitäten aus den paarigen Flossen evolutionär hervorgegangen sind.[2] Sie unterschieden sich jedoch im Knochenaufbau und in der Embryonalentwicklung, so dass ein evolutionärer Übergang aus den Einzelelementen schwer erklärbar ist.
Paarige Strahlenflossen

Den Extremitäten der Tetrapoden entsprechen bei Knochenfischen (Osteichthyes) und Knorpelfischen (Chondrichthyes) die Brust- und Bauchflossen, die Strahlenflossen genannt werden. Im Innern des Flossenansatzes befinden sich in der Regel mindestens vier proximale, rumpfnahe Knochen (Basalia) in antero-posteriorer Richtung im Gegensatz zu einem Knochen (Zeugopod) bei den Tetrapoden. Bei den höher entwickelten Strahlenflossern (Actinopterygii) setzen die Flossenstrahlenträger (die vier Basalia oder Radialia) direkt am primären Schultergürtel (Scapula, Coracoid) an. Sie tragen die Flossenstrahlen, die Lepidotrichia die aus Schuppen entstanden sind. Der überwiegende Teil der Strahlenflossen besteht aus den knöchernen Flossenstrahlen (Radii, Sg. Radius) und der Schwimmhaut (Patagium), die von den Radien aufgespannt wird. Die Muskeln für die Flossenbewegung sitzen bei allen Knochenfischen nur am Flossenbasisskelett an. Entsprechend ist die gesamte Flossenbasis, d. h. Flossenbasisskelett nebst Muskeln, bei Strahlenflossern eher unscheinbar. Strahlen sind nicht homolog zu Fingern und Zehen. Die Knochen von Lungenfischen und Quastenflossern ähneln stärker der Bauform der Tetrapodenextremität.
Tetrapodenextremität
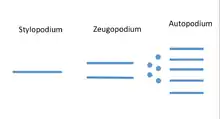
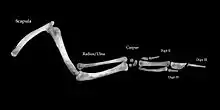
Die Tetrapodenextremität besteht aus einem langen Knochen (Stylopodium), dem Humerus (Oberarmknochen) bzw. Oberschenkelknochen (Femur), der über ein Gelenk mit der Schulter bzw. dem Becken verknüpft ist. Daran schließt sich das Zeugopodium an, zwei parallele Langknochen, am Arm Elle (Ulna) und Speiche (Radius), verbunden durch das Ellenbogengelenk, entsprechend beim Fuß Schienbein (Tibia) und Wadenbein (Fibula) mit dem darüberliegenden Knochen verbunden durch das Kniegelenk. In distaler Richtung folgt das Autopodium (Hand/Fuß), das sind zunächst am Arm die Handwurzelknochen (Karpalknochen) bzw. am Bein die Fußwurzelknochen (Tarsalknochen). An diese sind am Arm die Finger und am Fuß die Zehen distal angebunden. Die Anzahl der distalen Elemente an einer Extremität ist variabel. Sie beträgt als "Grundtyp" 5[2] und kann bis auf einen Zeh reduziert sein. Sie muss an Vorder- und Hinterextremität nicht gleich sein.
Transformation Flosse - Extremität
Anatomische Vergleiche



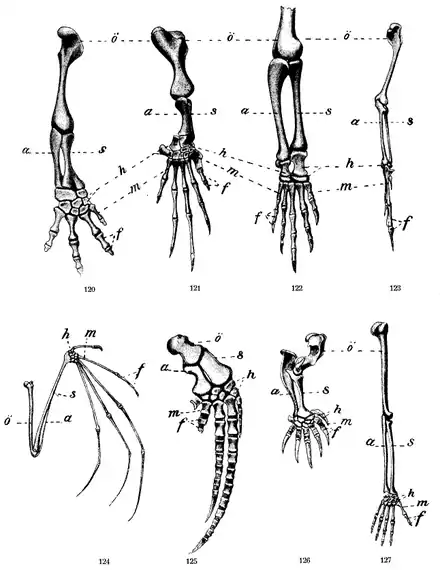
Richard Owen beschrieb 1849 in On the Nature of Limbs („Über die Natur der Gliedmaßen“) die Systematik von Wirbeltierextremitäten. Er entdeckte das regelmäßige Auftreten von einem über ein Gelenk an die Schulter bzw. das Becken angebundenen großen Knochen, daran über ein Gelenk in proximo-distaler Richtung angeschlossen zwei weitere parallele lange Knochen, dann eine Reihe kleiner Knöchelchen und schließlich die Hand- bzw. Zehenknochen von bis zu 5 distalen Elementen. Owen erkannte die entsprechenden Knochen bei Menschen, anderen Säugetieren und Vögeln als homolog. Darüber hinaus sah er aber auch Brust- und Beckenflossen von Fischen als homolog zu den Extremitäten der Tetrapoden.[3]
Die Homologie von Fischflossen mit Tetrapodenextremitäten blieb lange rätselhaft, da keine Knochenverwandtschaft hergestellt werden konnte. Ende des 19. Jahrhunderts galt Eusthenopteron, ein 380 Millionen Jahre altes Quastenflosserfossil aus der kanadischen Provinz Quebec, als Kandidat für Amphibienvorläufer, da man bei ihm einen Einzelknochen am Schultergürtel ausgemacht hatte, der als homologes Teil des Oberarms gedeutet wurde. Der an der Ostküste Grönlands Anfang der 1930er Jahre entdecke Ichthyostega wies erstmals vollständige Gliedmaßen einschließlich Finger und Zehen auf. Seine Wirbel waren amphibienähnlich. Acanthostega, ebenfalls aus dem Devon und in Ostgrönland gefunden, hat ebenfalls vollständige Gliedmaßen, zudem aber an den vorderen und hinteren Extremitäten je 8 radial angelegte Zehen, die eine paddelartige Flosse bilden.[4] Seine Vorder- und Hinterextremitäten waren so gebaut, dass die Knochen den schweren Körper nicht auf dem Land tragen konnten.[5] Für ausreichend Lokomotion an Land fehlten Acanthostega auch die notwendigen Gelenke an Ellenbogen und Knie.[6] Die Gliedmaßen der Landwirbeltiere sind demnach keine evolutionäre Veränderung im Zuge des Landgangs, sondern wurden bereits im Wasser entwickelt, zumal es bereits Vorgängerstufen zwischen Ichthyostega bzw. Acanthostega und früher lebenden Fischen gegeben haben musste. 1995 wurde in Philadelphia, USA, ein Fund einer 365 Millionen Jahre alten Fischextremität gemacht (Sauripterus). Der zugehörige Körper fehlt. Das Tier besaß am Rumpf einen einzelnen Knochen und am Rand der Flossen acht Knochenstäbe. Diese wurden als Zehenvorläufer beschrieben.[7]
Tiktaalik, ein amphibien-ähnliches, 375 Millionen Jahre altes Fossil, gefunden von Neil Shubin und Kollegen 2004 auf Ellesmere Island, weist die größte Ähnlichkeit mit dem von Owen beschriebenen Extremitätenprinzip auf. Das Tier hat Schulter, Ellenbogen und Handgelenk, bestehend aus den gleichen Oberarm-, Unterarm-, Handgelenksknochen wie beim Mensch. Es konnte sich auf dieser Extremität abstützen, ähnlich wie rezente Schlammspringer. Dafür konnte sich der Ellenbogen beugen, unterstützt durch große Brustmuskulatur. Ellenbogen und Knie zeigen anders als beim Mensch in dieselbe Richtung.[4] Als erster Tetrapod mit je 5 nach vorne gerichteten, zum Gehen an Land geeigneten Zehen an den Gliedmaßen wird Pederpes aus dem frühes Karbon gesehen, etwa 30 Millionen Jahre nach Tiktaalik.[8]
Weder bei Sauripterus noch bei Tiktaalik kann die frühe Transformation einer Flosse mit Strahlen zu einer Extremität mit Zehen nachvollzogen werden. Hier fehlen Zwischenformen. Der Übergang ist maßgeblich begleitet vom irreversiblen Verlust skelettärer Elemente und der gleichzeitigen evolutionären Innovation anderer Elemente (Autopodium). Das Ergebnis ist, dass keine homologen Knochen existieren zwischen der Mausextremität und der Zebrafisch-Brustflosse.[9]
Entwicklungsvergleiche
Bei der Tetrapodextremität kondensiert das Mesenchym der Knospe. Mesenchym-Zellen aggregieren und differenzieren anschließend zu Knorpelzellen (s. Extremitätenentwicklung). Es erfolgt also zuerst die individuelle Ausbildung der einzelnen Elemente und anschließend deren Chondrogenisierung zu Knorpel. Bei der Strahlenflosse der Knochenfische ist der Entwicklungsprozess umgekehrt. Zuerst erfolgt die Knorpelbildung und anschließend die individuelle Differenzierung der einzelnen Elemente.[2]
.jpg.webp)
Die Embryonalentwicklung der Extremität bei Hühnchen und Maus wird mitbestimmt durch eine Organisatorregion ZPA (Zone polarisierender Aktivität) auf der posterioren Seite der Knospe. In der ZPA wird das Protein Sonic hedgehog ausgeschüttet (s. Extremitätenentwicklung). Wird diese Region im Labor beim Hühnchenembryo entfernt und bei einem anderen zusätzlich zur bestehenden ZPA auf der anterioren Seite eingepflanzt, kommt es zu einer spiegelbildlichen Verdoppelung der Zehen.[10] Dieses Experiment wurde beim Rochen, einem Knorpelfisch, durchgeführt. Dabei konnte gezeigt werden, dass die Flosse ebenfalls Verdoppelung distaler Elemente aufweist. Das gelang auch beim Hai, ebenfalls ein Knorpelfisch. Eine Verwandtschaft genetischer Entwicklungsprozesse in der Flosse evolutionär alter Fische mit denen in der Extremitätenknospe bei Huhn und Maus konnte so nachgewiesen werden.[4] Auch mit der Expression von Alx4, Pax9, Hand2 und Gli3 in der Brustflosse des Katzenhais und der Extremitätenknospe der Maus konnten Vergleiche angestellt werden, die Hinweise für den Übergang von Flosse zu Tetrapodenextremität liefern.[11] Ebenso wurden in der Brustflosse unter anderem vom Zebrafisch[12] für bestimmte Hox-Gene vergleichbare (dreiphasenartige) Expressionsmuster entdeckt, die aus der Extremitätenentwicklung bekannt sind.[13] Hox-Gene vom Zebrafisch wurden in einem Versuch in der Knospe der Maus exprimiert und zeigten dort proximale Expressionsmuster. Dadurch wurde belegt, dass diese Genregulationsmechanismen bereits vor der Flosse-Extremitäten-Transformation existierten.[14][15] Verstärkte Anstrengungen gehen heute dahin, anstatt Mutationen von Entwicklungsgenen Veränderungen von Cis-Elementen zu analysieren, die für die Genregulierung der Flosse bzw. Extremität eine Schlüsselrolle spielen.[1]
Variabilität und Umformungen der Tetrapodenextremität
Robustheit der pentadaktylen Bauform
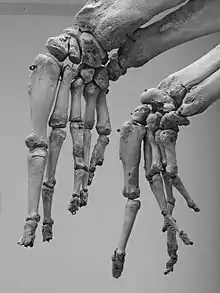
Die Tetrapodenextremität ist eine robuste anatomische Form. So kommt das fünffingrige (pentadaktyle) System etwa bei Mäusen und Kröten genauso wie bei Elefanten, Pferden und Walen vor. Da nicht angenommen werden kann, dass die Embryonen solch unterschiedlicher Arten zum Zeitpunkt der Extremitätenentwicklung gleich groß sind, müssen die für die Fortbildung relevanten Entwicklungsmechanismen evolutionär größenunabhängig sein. Gleichzeitig zeichnet sich die Extremität evolutionär durch eine hohe Anpassungsfähigkeit aus, wie man an unterschiedlichen Formen bei Wirbeltierarten erkennt. Beide Eigenschaften erscheinen intuitiv widersprüchlich. Andreas Wagner konnte jedoch zeigen, dass robuste Formen mit ausgeprägten Gennetzwerken generell bessere Voraussetzungen für Variation und Innovation besitzen als weniger robuste.[9]
Die pentadaktyle Obergrenze der Hand (fünf Finger) ist dennoch nicht abschließend geklärt. Als zwei mögliche Begründungen gibt Jennifer A. Clack an, dass die Extremitätenknospe in der Embryonalentwicklung ein physikalisch begrenztes Ausmaß hat. Das ermöglicht entweder eine größere Zahl kleinerer Zehen oder eine geringere Zahl größerer Zehen. Die Anforderung, das Körpergewicht beim Gehen tragen zu müssen, spricht dann eher für eine geringere Anzahl stärkerer Zehen. Fünf Zehen werden zweitens als möglicherweise ökonomisch beste und stabilste Alternative für die Anordnung auf den Karpalknochen (Hand) bzw. Tarsalknochen (Fuß), um die erforderliche Einwärtsdrehung (Pronation) und Auswärtsdrehung (Supination) ausüben zu können.[16]
Frühe Tetrapoden (z. B. Acanthostega) wurden wegen der Ähnlichkeit der Zehen eher als polydaktyl, denn als sieben- oder achtzehig interpretiert.[17] Jennifer A. Clack vertritt die Auffassung, dass Acanthostega an keiner Extremität zwei identische Zehen aufweist und somit die Zehenzahl weder pentadaktyl noch polydaktyl ist.[18] Wirbeltierarten, die im Standard mehr als fünf Finger oder Zehen an einer Extremität haben, sind sehr selten. Großer Panda und Maulwurf besitzen verformte Mittelhandknochen mit Zehencharakter. Ausnahmen mit selektiver Einflussnahme des Menschen sind bestimmte polydaktyle Populationen der Katze (Maine-Coon-Katze) und der Norwegische Lundehund. Galis führt Entwicklungsconstraints als Grund dafür an, dass eine größere Fingerzahl unterbunden wird.[19] Eine Studie von 2015 belegt das Vorhandensein eines echten sechsten Zehs präaxial zum großen Zeh (Pollux) am Hinterfuß einer Krallenfroschart (Xenopus tropiclais).[20] Dies ist der erste empirische Nachweis von standardmäßigen sechs Zehen bei einer rezenten Tetrapodenart.
Reduktion der distalen Strahlenanzahl
Der Flügel beim Vogel hat drei Zehen. In der Entwicklung zeigen sich in der Knospe zunächst fünf Anlagen, von denen vier in der Kondensationsphase chondrogenisieren und nur die drei mittleren ossifizieren. Zehenanlagen konnten somit über Millionen Jahre erhalten bleiben.[2][21] Eine zweite Theorie der Zehenreduzierung im Vogelflügel und beim Alligator, vorgelegt von Günter P. Wagner, geht von einer homoiotischen Transformation aus (Homeosis). Sie besagt hier, dass die Zehen 1, 2 und 3 an den Embryonalpositionen der Zehen 2, 3 und 4 wachsen und deren Identität annehmen.[22]
Die extreme Zehenlänge der Fledermaus-Vorderextremität (Flügel) sind in einem frühen embryonalen Entwicklungsstadium (Tag 16 nach Befruchtung) und somit nach erfolgter Kondensations- und Segmentationsphase in der Extremitätenknospe etwa relativ gleich lang wie die der Maus am Tag 12,5. Die erst ab dem 20. Tag folgende Verlängerung insbesondere der Zehen 3, 4 und 5 der Fledermaus konnte mit erhöhter Expression des Bone morphogenetic protein Bmb2 in Verbindung gebracht werden. Bmp2 stimuliert die Knorpelbildung und -differenzierung und vergrößert die Zehenlänge in der Embryonalentwicklung.[23] Die Evolution der Fledermaus wird somit mit Entwicklungsveränderungen im Längenwachstum und in der Längendifferenzierung von Knorpelgewebe in der vorderen Extremität begründet.
Reduktion der Anzahl paralleler mittlerer Röhrenknochen
_(14578875868).jpg.webp)
Bie einigen Tierarten sind Knochen des Zeugopodiums, also Elle und Speiche oder auch Schienbein und Wadenbein mit einander verschmolzen, was Pronation und Supination der Pfoten unmöglich macht. Diese Erscheinung betrifft beispielsweise die vordere Extremität des Europäischen Laubfroschs. Diese Degeneration verdeutlicht, dass die Froschlurche zwar eine etwa hinsichtlich der Lungenentwicklung urtümliche Tiergruppe sind, aber frühen Landwirbeltieren nicht in jeder Hinsicht näher stehen als etwa heutige Pferde und Menschen.
Weblinks
- How limbs evolved from fins. Scitable by Nature Education 17. Februar 2014.
- Tohru Yano, Koji Tamura: The making of differences between fins and limbs. In: J Anat. 222(1), Jan 2013, S. 100–113, PMC 3552418 (freier Volltext)
- Genetic clue to how limbs evolved from fins. BBC News, Science & Environment. 24. Januar 2014.
- Elizabeth Mitchell: Fish Fins Are Not Fingers That Failed. 28. Januar 2014.
- How did paired fins evolve? How did limbs evolve? Courses Washington Edu.
Einzelnachweise
- A. A. Abbasi: Evolution of vertebrate appendicular structures: Insight from genetic and palaeontological data. In: Dev Dyn. 240(5), Mai 2011, S. 1005–1016. doi:10.1002/dvdy.22572.
- Günter P. Wagner: Homology, Genes and Evolutionary Innovation. Princeton University Press, 2014.
- Peter J. Bowler: Find and Limbs and Fins into Limbs. The Historical Context 1840–1940. In: Brian K. Hall (Hrsg.): Fins into Limbs. Evolution, Development and Transformation. University of Chicago Press, 2007, ISBN 978-0-226-31336-8, S. 7–14.
- Neil Shubin: Der Fisch in uns. Eine Reise durch die 3.5 Milliarden alte Geschichte unseres Körpers. S. Fischer 2008.
- Jennifer A. Clack: Gaining Ground. The Origin and Evolution of Tetrapods. 2. Auflage. Indiana University Press, 2012, ISBN 978-0-253-00537-3, S. 173.
- Jennifer A. Clack: Gaining Ground. The Origin and Evolution of Tetrapods. Indiana University Press, 2012, S. 441.
- E. B. Daeschler, N. H., Shubin, K. S. Thomson, W. W. Amaral: A Devonian tetrapod from North America. In: Science. 265, Jul 1994, S. 639–642.
- Jennifer A. Clack: Gaining Ground. The Origin and Evolution of Tetrapods. Indiana University Press, 2012, S. 273.
- A. Wagner: The Origins of Evolutionary Innovations: A Theory of Transformative Change in Living Systems. 2011.
- W. Saunders, M. T. Gasseling: The proximo-distal sequence of origin of the parts of the chick wing and the role of the ectoderm. In: Journal of Experimental Zoology. 108(3), Aug 1948, S. 363–403.
- Centre of Genomic Regulation.Key genetic event underlying fin-to-limb evolution. (18. August 2015)
- Daegwon Ahn, Robert K. Ho: Tri-phasic expression of posterior Hox genes during development of pectoral fins in zebrafish: Implications for the evolution of vertebrate paired appendages. In: Developmental Biology. Vol. 322, Issue 1, 1. Oktober 2008, S. 220–233.
- Marcus C. Davis: The Deep Homology of the Autopod: Insights from Hox Gene Regulation. In: Integr. Comp. Biol. 2013. doi:10.1093/icb/ict029.
- J. M. Woltering, D. Noordermeer, M. Leleu, D. Duboule: Conservation and Divergence of Regulatory Strategies at Hox Loci and the Origin of Tetrapod Digits. In: PLoS Biol. 12(1), 2014, S. e1001773. doi:10.1371/journal.pbio.1001773
- Anm.: Die Tetrapodenextrimität hat sich aus der Fleischflosse (Sarcopterygium) der Sarcopterygii entwickelt, die nur entfernt verwandt mit der Maus sind. Deren Extremitäten haben somit wenig mit der Actinopterygierflosse zu tun (vgl. Abb. "Wichtige Etappen der Extremitätenevolution"). Daher ist ein Vergleich der Mausextremität mit der Brustflosse des Zebrafisches (ein Actinopterygier) nur sehr bedingt aussagekräftig
- Jennifer A. Clack: Gaining Ground. The Origin and Evolution of Tetrapods. 2012, S. 253.
- Anm.: Zur Gegenposition vgl.: Joost M. Woltering, Axel Meyer: The phantoms of a high-seven - or - why do our thumbs stick out? In: Front Zool. 12, 2015, S. 23. doi:10.1186/s12983-015-0117-x. PMC 4570229 (freier Volltext)
- Jennifer A. Clack: Gaining Ground. The Origin and Evolution of Tetrapods. Indiana University Press. 2012, S. 136, 168.
- F. Galis, J. J. M. Alphen: Why Five Fingers? Evolutionary Constraints on Digit Numbers. In: Trends in Ecology and Evolution. Volume 16, Number 11, 1. November 2001, S. 637–646(10)
- Shinichi Hayashi, Takuya Kobayashi, Tohru Yano, Namiko Kamiyama, Shiro Egawa, Ryohei Seki, Kazuki Takizawa, Masataka Okabe, Hitoshi Yokoyama, Koji Tamura: Evidence for an amphibian sixth digit. In: Zoological Letters. 1, 2015, S. 17. doi:10.1186/s40851-015-0019-y
- D. Capek, B. D. Metscher, G. B. Müller: Thumbs Down: a molecular-morphogenetic approach to avian digit homology. In: J. Exp. Zool. (Mol. Dev. Evol.). 322B, 2014, S. 1–12.
- Günter P. Wagner: The developmental evolution of avian digit homology: An update. In: Theory in Biosciences. 124, 2005, S. 165–183.
- Karen E. Sears, Richard R. Behringer, John J. Rasweiler, Lee A. Niswander: Development of bat flight: Morphologic and molecular evolution of bat wing digits. In: PNAS. vol. 103, no. 17, 25. April 2006, S. 6581–6586.