Flösselhechte
Die Flösselhechte (Polypteridae, Polypteriformes, von altgriechisch πολύ polý, deutsch ‚viel‘ und πτερόν pterón ,Flügel‘ ,Flosse‘), auch Flösselfische oder einfach nur Flössler genannt, sind eine Familie und Ordnung der Knochenfische (Osteichthyes). Da sie sich morphologisch stark von allen anderen Knochenfischen unterscheiden, werden sie in eine eigene Unterklasse, die Cladistia gestellt. Die Familie besteht aus zwei Gattungen, den eigentlichen Flösselhechten (Polypterus) und der monotypischen Gattung Erpetoichthys, zu der nur der Flösselaal (Erpetoichthys calabaricus) gehört. Für die europäische Wissenschaft wurden die Flösselhechte während Napoleons Ägyptenfeldzug von Étienne Geoffroy Saint-Hilaire, der die Truppen von 1798 bis 1801 als Wissenschaftler begleitete, entdeckt.[1]
| Flösselhechte | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Senegal-Flösselhecht (Polypterus senegalus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Unterklasse | ||||||||||||
| Cladistia | ||||||||||||
| Cope, 1871 | ||||||||||||
| Wissenschaftlicher Name der Ordnung | ||||||||||||
| Polypteriformes | ||||||||||||
| Bleeker, 1859 | ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Polypteridae | ||||||||||||
| Bonaparte, 1838 |
Einige Arten der Flösselhechte werden als ausgefallene Aquarienfische gehalten. Für Evolutionsbiologen und Paläontologen ist die Fischgruppe wichtig, da sie als lebendes Muster für die Morphologie der ursprünglichen Knochenfische dienen kann.
Verbreitung
Flösselhechte kommen ausschließlich in Süßgewässern des tropischen Afrika vor. Der Flösselaal lebt in Flussmündungen von Nigeria bis zur Republik Kongo und verträgt auch leichtes Brackwasser. Das Verbreitungsgebiet der Flösselhechte beginnt südlich der Sahara, nur im Nil kommt der Nilflösselhecht (Polypterus bichir) weiter nördlich bis Ägypten vor. Im Süden endet das Verbreitungsgebiet mit der Südgrenze des Kongobeckens und erreicht nicht mehr das Stromgebiet des Sambesi. In Ostafrika kommen Flösselhechte noch im Victoriasee, im Turkana-See, Tanganjikasee und Rukwasee, aber nicht mehr im Malawisee und in zum Indischen Ozean strömenden Flüssen vor.
Merkmale
_-_TIMEA.jpg.webp)
Flössler werden 23,5 Zentimeter bis einen Meter lang. Ihre Gestalt ist langgestreckt, aal- oder schlangenähnlich beim Flösselaal. Namensgebend ist die aus 5 bis 18 einzelnen, hintereinander angeordneten Flösseln (Pinnulae) bestehende Rückenflosse. Die einzelnen Flössel werden an ihrer Vorderseite jeweils von einem zweispitzigen, seitlich mit einer scharfen Kante versehenen Flossenstachel gestützt, der über ein Loch in seiner vorderen Basis in einem schräg in der Muskulatur sitzenden Flossenträger (Pterygiophor) verankert ist. An der Hinterseite des Flossenstachels befinden sich schräg sitzende, aus zusammengewachsenen Knochenschuppen bestehende Lepidotrichen, die eine kleine Flossenmembran stützen.[1] Die Flössel können durch jeweils einen Muskel aufgerichtet und niedergelegt werden. Seitenbeuger für die Flössel fehlen. Bei der weit hinten, direkt vor der Schwanzflosse sitzenden Afterflosse sind sie dagegen vorhanden und bei der Paarung nötig, wenn die Männchen sie seitwärts zur Geschlechtsöffnung der Weibchen drehen, falten und so eine Besamungstasche bilden.[2]
Das Achsenskelett der Polypteriden ist gut entwickelt. Sie verfügen über verknöcherte, an beiden Seiten konkave Wirbelkörper, nach oben gerichtete Neuralfortsätze (Supraneuralia), Rippen und zusätzlich dorsal (zum Rücken hin) gerichtete „obere“ Rippen, die mit den Schuppen entlang der Seitenlinie in je einer Gelenkgrube verbunden sind.[2]
Körperpanzer
Der Körper der Flösselhechte ist von rhombenförmigen, in schrägen Reihen verlaufenden Ganoidschuppen bedeckt, die einen geschlossenen Panzer bilden und dem Exoskelett der ursprünglichen Knochenfische entsprechen (Plesiomorphie). Die Schuppen sind durch Fortsätze und Gelenkgruben miteinander verbunden und bilden Schuppenhalbringe auf der rechten und linken Körperseite, die durch Schlussschuppen auf der Mittellinie des Rückens und des Bauches miteinander verbunden sind. Die aufeinander folgenden Schuppenringe sind überschiebbar. Unterhalb der Ganoidschuppen können sich noch einzelne oder zu Leisten verbundene Odontoden befinden, auf die letztlich auch die Schuppen zurückgehen. Die Kollagenfasern der Haut unterhalb der Schuppen spiegeln in ihrem gekreuzten Verlauf die Anordnung der Ganoidschuppen wider. Der Körperpanzer dient dem Schutz, schränkt aber die Möglichkeit der Körperkrümmung bei der anguilliformen Schwimmweise des Flösselaals ein.[3] Die Fortbewegung erfolgt daher ähnlich wie bei den Lippfischen (Labridae) vorwiegend mittels der Brustflossen (also labriform), allerdings infolge deren größerer Komplexität wesentlich „eleganter“.
Brustflossen
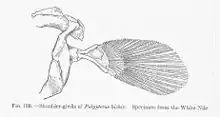 Schultergürtel und Brustflossenskelett von Polypterus bichir
Schultergürtel und Brustflossenskelett von Polypterus bichir Polypterus weeksii, mit abgespreizten, auf muskulösen Stielen sitzenden Brustflossen
Polypterus weeksii, mit abgespreizten, auf muskulösen Stielen sitzenden Brustflossen
Die Brustflossen der Flössler (Brachiopterygien) sind fächerförmig, sitzen auf muskulösen kurzen Stielen und ähneln somit denen des Australischen Lungenfischs (Neoceratodus forsteri) und der Quastenflosser (Coelacanthiformes), was früher zu Spekulationen über eine Zugehörigkeit oder enge Verwandtschaft der Flössler mit den Fleischflossern (Sarcopterygii) führte. Der innere Aufbau, sowohl was das Skelett als auch die Muskeln betrifft, ist jedoch völlig anders, unterscheidet sich allerdings auch stark von dem anderer Strahlenflosser. Das Skelett des Brustflossenstiels besteht aus drei verknöcherten, zum Körper hin gelegene Pterygialia, von denen die äußeren stabförmig sind und ein mittleres, plattenförmiges umfassen. Die drei Elemente laufen zum Körper hin spitz zu einem einzigen Gelenkkopf zusammen, der am Schultergürtel (Scapulocoracoid) artikuliert und eine starke Beweglichkeit ermöglicht. Nach außen hin verbreitern sie sich fächerförmig und zwei Reihen von Radialia, von denen die inneren stabförmig, die nach außen gerichteten kugelförmig sind, schließen sich an. Die kugelförmigen Radialia werden von der Basis der Brustflossenstrahlen umfasst.[2]
Schädel
Der Schädel der Flössler ist massiv und bildet ein vollständig geschlossenes Dermatocranium. Das Schädeldach besteht aus großen, paarigen Knochenplatten. Besonderheiten sind die feste Verbindung des Maxillare mit dem Praeoperculare, das Auftreten des Quadratojugale, eines zusätzlichen Knochens in der „Wangenregion“, und ein weit nach hinten verschobenes Parasphenoid, das den Aortakanal umgibt.[1] Oberhalb der Kiemendeckelregion befindet sich eine flexible Zone mit einer Serie kleiner Knochen, von denen zwei, die Spiracularia, in der Verschlussfalte des großen Spritzloches liegen und aktiv bewegt werden können. Flösselhechte müssen atmosphärische Luft atmen und nehmen diese über den Mund oder über die Spritzlöcher auf; verbrauchte Luft wird über die Kiemenöffnungen abgegeben. Auf der unteren Seite der Kiemenregion fehlen die Branchiostegalstrahlen. Stattdessen wird sie durch paarige Kehl-Knochenplatten (Gularia) geschützt. Nach vorne schließt sich ein flexibler, muskulöser Mundboden an, der wichtig für die Luftatmung und den Beutefang durch Saugschnappen ist. Die Kieferränder und der vordere Gaumenbereich sind mit konischen, spitzen und nach hinten gebogenen Fangzähnen besetzt. Auf dem Ectopterygoid, einem weiter hinten liegenden Knochen im „Gaumendach“ und auf dem Praearticulare, einem Unterkieferknochen, schließen sich stumpfkonische Zähne an. Die Beißkraft der Flössler ist hoch. Im Kiemenskelett der Flössler sind nur vier Kiemenbögen ausgebildet, der letzte, unvollständige Kiemenbogen ist mit Zahnplatten besetzt, die dazu dienen, die aufgenommene Nahrung in die Speiseröhre zu transportieren.[2] Der (paarige) fünfte Bogen, die Pharyngealia inferiora aller anderen Strahlenflosser, fehlt hier also.[4]
Lunge
Flösselhechte besitzen eine primitive, paarige Lunge mit zwei verschieden langen Lungenflügeln, die eher als Lungensäcke zu bezeichnen sind. Der linke Lungensack ist deutlich kürzer, was, analog zu den Schlangen, auf Platzmangel zurückzuführen ist. Der längere rechte Lungensack kann sich bei einigen Arten innerhalb der Körperhöhle über die Afteröffnung hinaus erstrecken.[5] Sowohl bei Polypterus als auch bei Erpetoichthys ist der Durchmesser beider Lungensäcke gleich groß, bei Letztgenanntem ist der Durchmesser beider Lungensäcke aufgrund der schlanken Gestalt des Fisches deutlich geringer. Die Lungensäcke sind sehr einfach gebaut, transluzent und ungekammert. Sie weisen lediglich Längsfurchen auf, die dicht mit spezialisierten Zellen bestanden sind.[5] Die Lunge der Flösselhechte geht embryonal aus einem bauchseitigen (ventralen) Divertikel des Vorderdarms hervor und bleibt zeitlebens über den sogenannten Ductus pneumaticus mit dem Verdauungstrakt verbunden,[5][6] sodass die Tiere nicht über eine Luftröhre, sondern über die Speiseröhre ein- und ausatmen. Der überwiegende Teil der Lunge liegt jedoch rückenseitig (dorsal) des Verdauungstraktes.
Neben der Funktion als Atmungsorgan erfüllt die Lunge allerdings auch eine Schwimmblasenfunktion und erlaubt den Fischen mit nur wenigen Flossenschlägen im Wasser zu schweben.[7]
Sinnesorgane
Flösselhechte sind Makrosmaten, die sich weitgehend durch ihren Geruchssinn orientieren. Ihre röhrenförmigen Nasenöffnungen (Tentakel) führen zu einem stark vergrößerten und kompliziert gebauten Riechepithel, das eine Oberfläche von 3200 mm² erreichen kann und unter den Fischen nur mit dem der Aale vergleichbar ist.[8] Kopfbewegungen, die an ein gezieltes „Schnüffeln“ erinnern, sind eine oft beobachtete Verhaltensweise. Der Geruchssinn ist für die Nahrungssuche und das Fortpflanzungsverhalten wichtig. Auf dem Rumpf befinden sich drei Seitenlinien, die in Gruben in den Schuppen eingesenkt liegen. Auf dem Schädel ist das Seitenlinienorgan wie gewöhnlich bis auf kurze Grübchenlinien in knöcherne Kanäle eingeschlossen, die sich nur über Poren nach außen öffnen. Außerdem gibt es auf dem Schädel noch Felder für die elektrische Orientierung.[2]
Lebensweise

Flösselhechte leben vor allem in verkrauteten Uferbereichen stehender und langsam fließender Gewässer und, bei Hochwasser, in den Überschwemmungszonen. Tagsüber ruhen sie auf dem Gewässergrund, um in der Dämmerung und in der Nacht auf Nahrungssuche zu gehen. Der Beute nähern sie sich unbemerkt mittels ihrer Brustflossen, um dann plötzlich zuzuschnappen und sie unzerkaut zu verschlucken. Sie fressen unter anderem Insektenlarven, Würmer, Krebstiere, kleine Fische und Amphibien.[9] Flösselhechte können auch in Gewässern mit geringem Sauerstoffgehalt überleben und das Austrocknen ihres Wohngewässers eingegraben im Schlamm einige Zeit überdauern.[1]
Mit den kräftigen Flossenbasen ihrer Brustflossen sind Flösselhechte in der Lage, außerhalb des Wassers zu „laufen“. Dabei setzen sie die Flossen abwechselnd auf, während sie den Vorderleib um die jeweils aufgesetzte Flosse um mehr als 90° rotieren, woraus eine Art Schlängelgang resultiert, der dem von Salamandern und Eidechsen entfernt ähnelt. Es wird angenommen, dass sich so ähnlich auch die Vorfahren der Landwirbeltiere im Devon auf dem Trockenen bewegt haben (siehe unten).[10]
Als Parasiten der Flösselhechte sind unter anderem Hakensaugwürmer (Monogenea)[11] und Fadenwürmer (Nematoda)[12] bekannt.
Fortpflanzung

Das Fortpflanzungsverhalten ist durch Aquarien- und mühsame Freilandbeobachtungen erforscht worden. Bei der Balz schwimmen die Partner eng aneinandergeschmiegt, jagen sich oder das Männchen stupst das ruhende Weibchen an und streift es mit seiner geschwollenen Afterflosse. Auch Luftsprünge sollen vorkommen.[9]
Die Eier sind relativ groß (2,5 mm Ø), dotterreich und von einer klebrigen, mit Haftzotten versehenen Vitellinmembran umgeben. Die schlüpfenden Dottersacklarven sind wenig entwickelt und hängen mit Hilfe eines Sekrets aus einer Klebedrüse an Wasserpflanzen. Bei Störungen sind sie allerdings imstande zu fliehen. Die weiter entwickelten, zur aktiven Nahrungsaufnahme fähigen Larven haben äußere, aus dem Kiemendeckel ragende Kiemenbüschel und ähneln den Larven der Schwanzlurche und Lungenfische. Sie führen ein verstecktes Leben in der Vegetation und auf dem Bodengrund. Die äußeren Kiemen bleiben auch bei Jungfischen noch lange erhalten.
Systematik und Evolution
Äußere Systematik
Die Flösselhechte (Polypteridae) sind die einzige Familie der Ordnung Polypteriformes. Sie sind eine sehr urtümliche Gruppe der Knochenfische. Plesiomorphe Merkmale sind das Spritzloch und der Spiraldarm.[13] Die systematische Stellung der Polypteriformes war lange Zeit umstritten. Sie wurden, wegen ihrer fleischigen Brustflossenstiele, oft bei den Fleischflossern (Sarcopterygii) oder den paraphyletischen „Crossopterygii“ (Actinistia + Rhipidistia) eingeordnet.[1] Noch im Jahr 2004 kam eine Gruppe italienischer Wissenschaftler nach einem Vergleich von Fragmenten von Mitochondrien- und Kern-DNA zu der Schlussfolgerung, dass die Polypteriformes zu den Fleischflossern gehören und die rezente Schwestergruppe der Lungenfische (Dipnoi) seien,[14] eine Auffassung, die sich nicht durchsetzen konnte.
Lange Zeit wurde die Ordnung und wird es in eher konservativen Systematiken bis heute[15][16] zusammen mit den Störartigen (Acipenseriformes) und einer Reihe von ausgestorbenen Knochenfischgruppen, die vom Devon bis zum Unterjura lebten, der Unterklasse der Knorpelganoiden (Chondrostei) zugeordnet.
In der mit Hilfe kladistischer Methoden ermittelten modernen Systematik bilden sie innerhalb der Klasse der Strahlenflosser (Actinopterygii) eine eigene Unterklasse, die Cladistii bzw. Cladistia, die Schwestergruppe aller übrigen rezenten Strahlenflosser ist.[1][13][17][18]
Die systematische Stellung verdeutlicht folgendes Kladogramm:
| Knochenfische |
| ||||||||||||
Die Scanilepiformes, eine ausgestorbene Knochenfischordnung aus der Trias, bilden möglicherweise die Schwestergruppe der Flösselhechte.[19]
Innere Systematik
| Verwandtschaftsverhältnisse innerhalb der Polypteridae nach Suzuki et al. 2010.[20][21] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Heute sind 14 Arten anerkannt, wobei 13 der Gattung Polypterus zugeordnet werden und eine in die monotypische Gattung Erpetoichthys gestellt wird. Letztere, der Flösselaal, unterscheidet sich von den eigentlichen Flösselhechten (Polypterus) durch das Fehlen von Bauchflossen und den im Verhältnis wesentlich schlankeren Körper.
Eine neue Studie zeigt auf Datenbasis mitochondrialer DNA, dass Polypterus retropinnis die Schwesterart zu allen anderen Arten der Gattung Polypterus darstellt.[20][21]
- Eigentliche Flösselhechte (Polypterus) Lacépède, 1803
- Polypterus ansorgii Boulenger, 1910
- Nil-Flösselhecht (Polypterus bichir) Lacépède, 1803
- Polypterus congicus Boulenger, 1898
- Zaire-Flösselhecht (Polypterus delhezi) Boulenger, 1899
- Polypterus endlicherii Heckel, 1847
- Polypterus mokelembembe Schliewen & Schäfer, 2006
- Schmuck-Flösselhecht (Polypterus ornatipinnis) Boulenger, 1902
- Polypterus palmas Ayres, 1850
- Polypterus polli Gosse, 1988
- Polypterus retropinnis Vaillant, 1899
- Senegal-Flösselhecht (Polypterus senegalus) Cuvier, 1829
- Polypterus teugelsi Britz, 2004
- Polypterus weeksii Boulenger, 1898
- Erpetoichthys Smith, 1865
- Flösselaal (Erpetoichthys calabaricus) Smith, 1865
Fossilbericht
Die ältesten Fossilien, die den Flösselhechten zugeordnet werden, stammen aus der untersten Oberkreide (Cenomanium) von Afrika. Es handelt sich überwiegend um isolierte Flossenstacheln. Sie kommen aus der Wadi-Milk-Formation im Sudan, der Bahariya-Formation im nördlichen Ägypten sowie den Kem Kem Beds in Marokko und lassen sich 17 Arten zuordnen, die auf 9 Gattungen entfallen. Neben Polypterus (3 Arten) sind das die Gattungen † Bartschichthys (2), † Bawitius (1), † Inbecetemia (2), † Nagaia (1), † Saharichthys (1), † Sainthilairia (4), † Serenoichthys (1) und † Sudania (2).[22][23] Bawitius ist nur durch ein einzelnes bezahntes Ectopterygoid und einige Schuppen bekannt. Dieses Ectopterygoid ist allerdings etwa fünfmal größer als das heutiger Flösselhechte und muss zu einem sehr großen Individuum gehört haben.[23]
Funde aus der höheren Oberkreide (Coniacium–Santonium) stammen aus dem Ullemmeden-Becken im Niger. Von dort sind sechs der oben aufgezählten Gattungen bekannt, die ebenfalls nur fragmentarisch erhalten sind. In Afrika kommt in noch jüngeren Schichten nur noch Polypterus vor. Ein besonderer Fund stammt hierbei aus den „Anthracotheriiden-Schichten“ (spätes Miozän) des Tschad: Der Holotyp der Art Polypterus faraou ist ein faktisch vollständiges und damit das vollständigste Exemplar eines fossilen Flösselhechtes, das bislang entdeckt worden ist.[24] Der Flösselaal hingegen ist gänzlich ohne Fossilüberlieferung.
Außerhalb Afrikas sind Flösselhechtfossilien bislang nur in Südamerika gefunden worden. Die Gattungen † Dagetella und † Latinopollia entstammen der El-Molino- und Santa-Lucia-Formation des Maastrichtiums bzw. Paläozäns von Bolivien. Latinopollia ist zudem aus einer Lokalität in Brasilien bekannt. Post-paläozäne Vorkommen sind bislang nicht entdeckt worden. Diese Umstände legen nahe, dass Flösselhechte schon vor der Kreidezeit Süßgewässer in weiten Teilen des großen Südkontinentes Gondwana besiedelten. Nach Öffnung und Weitung des Südatlantiks wurden die afrikanischen von den südamerikanischen Populationen getrennt. Während Flösselhechte in Südamerika bereits im frühen Känozoikum komplett ausstarben, überlebten sie in Afrika bis heute.
Flösselhechte als mögliches rezentes Analogon für die Vorfahren der Landwirbeltiere
Flösselhechte sind die „primitivsten“ aller rezenten Strahlenflosser. Sie besitzen zahlreiche ursprüngliche Merkmale, die auch bei den längst ausgestorbenen fischartigen Fleischflossern des Devons vorhanden waren, aus denen die frühesten vierbeinigen Wirbeltiere und damit letztlich alle heutigen Landwirbeltiere (Tetrapoda), einschließlich des Menschen, hervorgingen (siehe → Landgang). Zu diesen Merkmalen gehören das für die Sauerstoffaufnahme aus der Luft geeignete Lungen-Schwimmblasen-Organ und, im Gegensatz zu den rezenten Lungenfischen, Brustflossen, die für die Bewegung an Land genutzt werden.[10] Zudem wird angenommen, dass auch die von Umwelteinflüssen abhängige Variabilität der Ausbildung des Phänotyps während der Individualentwicklung, die sogenannte Entwicklungsplastizität (engl.: developmental plasticity), bei den Flösselhechten ähnlich groß ist wie bei den fischartigen Fleischflossern des Devons.[10]
In einem achtmonatigen Versuch mit juvenilen Senegal-Flösselhechten (Polypterus senegalus) wurde 2014 erstmals eruiert, wie sich Flösselhechte körperlich entwickeln, wenn man ihnen die Möglichkeit ins Wasser zu gehen vollständig verwehrt. Dabei zeigte sich, dass die anfangs höchstens 70 Tage alten Versuchstiere nicht einfach nur überlebten. Stattdessen ging es ihnen in der neuen, wenngleich ideal gestalteten Umgebung sogar gut und sie zeigten infolge des fehlenden Auftriebs mit der Zeit eine Reihe körperlicher Anpassungen. Die Veränderungen betrafen sowohl die Muskulatur als auch den Knochenbau, insbesondere im Bereich der Brustflossen und des Schultergürtels. Zudem konnten die Versuchsindividuen signifikant besser auf dem Trockenen „laufen“ als die Individuen der überwiegend im Wasser gehaltenen Kontrollgruppe.[10]
Dies erlaubt Rückschlüsse darauf, wie die Evolution weitgehend vollaquatischer fischartiger Fleischflosser, wie etwa Eusthenopteron, über weniger fischartige Vertreter, sogenannte „Fischapoden“, wie etwa Tiktaalik, hin zu Tieren mit echten Beinen statt Flossen, wie etwa Ichthyostega, vor rund 400 Millionen Jahren ihren Anfang genommen haben könnte. Der Versuch zeigt, wie sowohl die Anatomie als auch das Verhalten von Tieren mit geeigneten körperlichen Voraussetzungen als Reaktion auf entsprechende Umweltveränderungen zu einem gewissen Grad plastisch modifiziert werden. Vor 400 Millionen Jahren könnten genetische Mutationen via Selektion solche anfangs jeweils nur auf phänotypischer Plastizität beruhenden Veränderungen in der betroffenen Population fixiert haben.[10] Die evolutionäre Abfolge wäre demnach nicht: zufällige genetische Mutation → natürliche Selektion → Adaptation in der Population, sondern umgekehrt: Veränderung der Umweltbedingungen → dauerhafte, noch nicht genetisch vererbbare phänotypische Adaptation → genetische Fixierung (genetische Assimilation) der phänotypischen Adaptation durch zufällige Mutationen.
Allerdings widerspricht dieses Szenario den bisherigen Erkenntnissen über den Ablauf des Landganges der Wirbeltiere, wonach Beine und Zehen bereits vor dem Übergang zu einer terrestrischen Lebensweise entstanden sein sollen.[25]
Nutzung und Gefährdung
Der Flösselaal und einige Arten der eigentlichen Flösselhechte werden gefangen und als Aquarienfische in wohlhabende Länder importiert. In großen Aquarien sind sie nicht allzu schwer zu halten, zeigen sich tagsüber aber kaum und können sich gegenüber kleineren Mitbewohnern räuberisch verhalten. Die Aquarien sollten versteckreich und nicht allzu stark beleuchtet sein. Der Schmuckflösselhecht wird im Aquazoo in Düsseldorf regelmäßig nachgezogen.[26]
Die Arten der Gattung Polypterus sind nach Angaben der IUCN nicht gefährdet.[27] Für Polypterus teugelsi stehen keine ausreichenden Daten zur Verfügung.[28] Der Flösselaal gilt jedoch als gering gefährdet. Sein küstennaher Lebensraum wird durch den Anbau von Ölpalmen zunehmend zerstört.[29]
Quellen
Literatur
- Peter Bartsch: Cladistia, (Polypteriformes, Brachyopterygii), Flösselhechte und Flösselaal. S. 228–232 in Wilfried Westheide & Reinhard Rieger: Spezielle Zoologie Teil 2: Wirbel und Schädeltiere, 1. Auflage, Spektrum Akademischer Verlag Heidelberg • Berlin 2004, ISBN 3-8274-0307-3.
- Kurt Fiedler: Lehrbuch der Speziellen Zoologie, Band II, Teil 2: Fische. Gustav Fischer Verlag, Jena 1991, ISBN 3-334-00339-6.
- Guillaume Lecointre, Hervé Le Guyader: Biosystematik: Alle Organismen im Überblick. Springer, Berlin 2005, ISBN 3-540-24037-3.
- Joseph S. Nelson: Fishes of the World. John Wiley & Sons, 2006, ISBN 0-471-25031-7.
- Günther Sterba: Süsswasserfische der Welt. 2. Auflage. Urania, Leipzig/Jena/Berlin 1990, ISBN 3-332-00109-4.
Einzelnachweise
- Lecointre & Guyader: Biosystematik. 2005 (siehe Literatur), S. 443–444.
- Bartsch: Cladistia. 2004 (siehe Literatur), S. 230.
- Bartsch: Cladistia. 2004 (siehe Literatur), S. 229.
- Ralf Britz, G. David Johnson: On the homology of the posteriormost gill arch in polypterids (Cladistia, Actinopterygii). Zoological Journal of the Linnean Society. Bd. 138, Nr. 4, 2003, S. 495–503, doi:10.1046/j.1096-3642.2003.t01-1-00067.x (alternativer Volltextzugriff: Smithsonian Libraries).
- Jeffrey B. Graham: Air-Breathing Fishes: Evolution, Diversity, and Adaptation. Academic Press, San Diego (CA) • London 1997, ISBN 0-12-294860-2, S. 73 ff.
- A. Lechleuthner, U. Schumacher, R. D. Negele, U. Welsch: Lungs of Polypterus and Erpetoichthys. Journal of Morphology. Bd. 201, Nr. 2, 1989, S. 161–178, doi:10.1002/jmor.1052010206.
- Bartsch: Cladistia. 2004 (siehe Literatur), S. 231.
- Fiedler: Lehrbuch der Speziellen Zoologie. 1991 (siehe Literatur), S. 258.
- Sterba: Süsswasserfische der Welt. 1990 (siehe Literatur), S. 22–23.
- Emily M. Standen, Trina Y. Du, Hans C. E. Larsson: Developmental plasticity and the origin of tetrapods. Nature. Bd. 513, 2014, S. 54–58, doi:10.1038/nature13708; siehe dazu auch: Noah Baker: How fish can learn to walk – Land-raised bichirs provide insight into evolutionary pressures facing first vertebrates to live on land. Nature Video vom 27. August 2014 (Kommentar auf englisch).
- Iva Přikrylová, Iveta Matějusová, Naďa Musilová, Milan Gelnar, Philip D. Harris: A New Gyrodactylid (Monogenea) Genus on Gray Bichir, Polypterus senegalus (Polypteridae) from Senegal (West Africa). The Journal of Parasitology. Bd. 95, Nr. 3, 2009, S. 555–560, doi:10.1645/GE-1652.1 (alternativer Volltextzugriff: University of Nebraska – Lincoln, komplettes Heft).
- Eva Řehulková, Vlastimil Baruš, Milan Gelnar: Two remarkable nematodes from the African reedfish Erpetoichthys calabaricus (Polypteriformes: Polypteridae). Helminthologia. Vol. 42, Nr. 3, 2005, S. 149–153 (PDF 2 MB).
- Peter Ax: Das System der Metazoa III. Ein Lehrbuch der phylogenetischen Systematik. Spektrum Akademischer Verlag, Heidelberg • Berlin 2001, ISBN 3-8274-1179-3, S. 181–183.
- Lucia Rocco, Domenico Costagliola, Maria Alessandra Morescalchi, Vincenzo Stingo: A molecular approach to systematics of Polypteriformes among Osteichthyes. Italian Journal of Zoology. Bd. 71, Nr. 4, 2004, S. 347–351 doi:10.1080/11250000409356594.
- Integrated Taxonomic Information System: Chondrostei.
- P. Myers, R. Espinosa, C. S. Parr, T. Jones, G. S. Hammond, T. A. Dewey: Order Polypteriformes. The Animal Diversity Web, 2008.
- Nelson: Fishes of the World. 2006 (siehe Literatur), S. 88.
- Bartsch: Cladistia. 2004 (siehe Literatur), S. 228.
- Sam Giles, Guang-Hui Xu, Thomas J. Near, Matt Friedman. Early members of ‘living fossil’ lineage imply later origin of modern ray-finned fishes. Nature, 2017; DOI: 10.1038/nature23654
- Dai Suzuki, Matthew C. Brandley, Masayoshi Tokita: The mitochondrial phylogeny of an ancient lineage of ray-finned fishes (Polypteridae) with implications for the evolution of body elongation, pelvic fin loss, and craniofacial morphology in Osteichthyes. BMC Evolutionary Biology. Bd. 10, Art.-Nr. 21, 2010, doi:10.1186/1471-2148-10-21
- Dai Suzuki, Matthew C. Brandley, Masayoshi Tokita: CORRECTION: The mitochondrial phylogeny of an ancient lineage of ray-finned fishes (Polypteridae) with implications for the evolution of body elongation, pelvic fin loss, and craniofacial morphology in Osteichthyes. BMC Evolutionary Biology. Bd. 10, Art.-Nr. 209, 2010, doi:10.1186/1471-2148-10-209
- Mireille Gayet, François J. Meunier, Christa Werner: Diversification in Polypteriformes and Special Comparison with the Lepisosteiformes. Palaeontology. Bd. 45, Nr. 2, 2002, S. 361–376, doi:10.1111/1475-4983.00241 (alternativer Volltextzugriff: ResearchGate).
- Barbara S. Grandstaff, Joshua B. Smith, Matthew C. Lamanna, Kenneth J. Lacovara, Medhat Said Abdel-Ghani: Bawitius, gen. nov., A Giant polypterid (Osteichthyes, Actinopterygii) from the Upper Cretaceous Bahariya Formation of Egypt. Journal of Vertebrate Paleontology. Bd. 32, Nr. 1, S. 17–26, doi:10.1080/02724634.2012.626823.
- O. Otero, A. Likius, P. Vignaud, M. Brunet: A new polypterid fish: Polypterus faraou sp. nov. (Cladistia, Polypteridae) from the Late Miocene, Toros-Menalla, Chad. Zoological Journal of the Linnean Society. Bd. 146, Nr. 2, 2006, S. 227–237, doi:10.1111/j.1096-3642.2006.00201.x (alternativer Volltextzugriff: ResearchGate).
- Stephanie E. Pierce, Jennifer A. Clack, John R. Hutchinson: Three-dimensional limb joint mobility in the early tetrapod Ichthyostega. Nature. Bd. 486, Nr. 7404, 2012, S. 523–526, doi:10.1038/nature11124.
- W. E. Engelmann: Zootierhaltung – Tiere in menschlicher Obhut: Fische. Verlag Harri Deutsch, Frankfurt am Main 2005, ISBN 3-8171-1352-8, S. 242–243.
- Polypterus in der Roten Liste gefährdeter Arten der IUCN 2014.2. Abgerufen am 28. Oktober 2014..
- Polypterus teugelsi in der Roten Liste gefährdeter Arten der IUCN 2014.2. Eingestellt von: T. Moelants, 2009. Abgerufen am 28. Oktober 2014..
- Erpetoichthys calabaricus in der Roten Liste gefährdeter Arten der IUCN 2014.2. Eingestellt von: P. Lalèyè, T. Moelants, B.D. Olaosebikan, 2009. Abgerufen am 28. Oktober 2014..
Weblinks
- Flösselhechte auf Fishbase.org (englisch)
- Polypteriformes auf Fishbase.org (englisch)
- Palæos: Polypteriformes (englisch)