Phthalocyanin
Phthalocyanin (von Phthalsäure; und gr. cyanos, κυανός, blau) ist der Namensgeber der Phthalocyanine, einer Klasse makrocyclischer Verbindungen mit einer alternierenden Stickstoff-Kohlenstoff-Ringstruktur.[4][5][6] Strukturell sind sie den verwandten Klassen organischer Farbstoffe wie dem Porphyrin und den Cyaninen ähnlich. Phthalocyanine zeichnen sich durch hohe chemische und thermische Stabilität aus. Phthalocyanine – im Allgemeinen abgekürzt als H2Pc – sind gegenüber konzentrierter Schwefelsäure beständig und lassen sich bei 500 °C im Vakuum sublimieren. Im Phthalocyanin sind vier Benzopyrrol-Einheiten über Stickstoff-(Aza-)Brücken miteinander verbunden. Der systematische Name lautet Tetrabenzotetraazaporphyrin.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
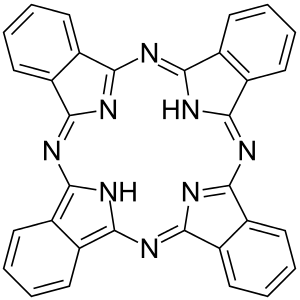 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phthalocyanin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C32H18N8 | |||||||||||||||||||||
| Kurzbeschreibung |
schwarze bis dunkelblau/purpurfarbene Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 514,54 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Das erste Auftreten eines unbekannten blauen Nebenproduktes ist 1907 beschrieben worden.[7] Heute ist bekannt, dass es sich dabei um ein metall-freies Phthalocyanin handelte. Die eigentliche Entdeckung des Phthalocyanins als Farbstoff geschah ebenfalls zufällig, als 1928 im schottischen Werk der Scottish Dyes Ltd. (ICI) in Grangemouth Phthalimid aus Phthalsäureanhydrid und Ammoniak in emaillierten Eisenkesseln hergestellt werden sollte. An einer Stelle, an der die Emaille bis zum Eisen abgeplatzt war, hatte sich eine dunkelblaue Substanz gebildet. In nachfolgenden Versuchen wurde erkannt, dass die blaue Farbe nicht nur mit Eisen, sondern auch durch Umsetzung von Phthalodinitril mit anderen Metallen wie Kupfer oder Nickel bzw. deren Salzen erhalten werden konnte.
Ein Jahr zuvor hatten Henri de Diesbach und E. von der Weid in der Zeitschrift Helvetica Chimica Acta[8] bereits über die Synthese und farbliche Brillanz des Kupfer-Phthalocyanins berichtet, ohne jedoch dessen wirtschaftliches Potential als Pigment zu erkennen. Die von Reginald Patrick Linstead 1933 postulierte Porphyrin-artige Struktur des Phthalocyanins konnte 1935 von Robertson durch eine Röntgenstrukturanalyse belegt werden. Damit war klar, dass die Phthalocyanine biologisch relevanten Metallkomplexen wie dem roten Blutfarbstoff Häm oder dem Chlorophyll der Pflanzen ähneln.
Die kommerzielle Produktion von Kupferphthalocyanin wurde bereits 1934 durch ICI aufgenommen. Bayer folgte 1936 und brachte die Substanz als Heliogenblau B auf den Markt. Die bisher verwendeten anorganischen Pigmente Ultramarin und Preußisch Blau wurden in den folgenden Jahren weitestgehend verdrängt. Später wurde die Palette der Metallphthalocyaninpigmente durch Austausch von Kupfer gegen Kobalt oder Nickel aber auch durch Chlorierung (Phthalocyaningrün) oder Sulfonierung (erhöhte Wasserlöslichkeit) des Grundkörpers erweitert.
Gewinnung und Darstellung
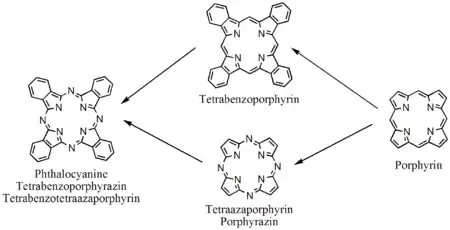
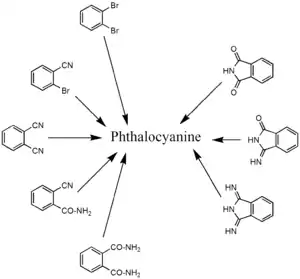
Der Phthalocyanin-Makrozyklus ist aus vier gleichen (Eck-)Bausteinen aufgebaut. Als Synthesestrategie bieten sich daher Ausgangsstoffe an, die diesen Ecken entsprechen. Bei diesen handelt es sich in der Regel um Derivate der Phthalsäure, wie beispielsweise Phthalodinitril, Phthalsäureanhydrid, Phthalimid oder Diiminoisoindol.
Herkömmliche Techniken
Zum einen können die Salze verschiedener Übergangsmetalle mit Phthalodinitril und Natriummethylat in einem geeigneten Lösungsmittel umgesetzt werden. Zum anderen kann die Umsetzung von elementaren Übergangsmetallen mit 1,3-Diiminoisoindol in Lösung erfolgen. In beiden Fällen wird bei 80–140 °C das entsprechende Metall-Phthalocyanin erhalten, beziehungsweise H2Pc im Falle der Abwesenheit von Metallen oder deren Salzen. Ebenfalls möglich ist die Umsetzung diverser Übergangsmetallsalze mit Harnstoff und Phthalsäureanhydrid in einem inerten, hoch-siedenden Lösungsmittel unter Verwendung von Ammoniumheptamolybdat als Katalysator und Tetramethylharnstoff als Promoter. Die Reaktionslösung benötigt hierbei eine Temperatur von 120 bis 250 °C. Die Verwendung anderer Phthalocyanin-Vorstufen ist bei diesem, auch industriell angewendeten, Prozess möglich. In Abwesenheit von Metallen oder deren Salzen wird hierbei ebenfalls H2Pc gebildet.
Bei der Herstellung von Phthalocyanin-Pigmenten können, sofern Di- oder Trichlorbenzole als Lösemittel verwendet werden, Chlorierte Biphenyle als unerwünschte Nebenprodukte entstehen.[9]
Mikrowellen
Für die Synthese von Metall-Phthalocyaninen durch Bestrahlung mit Mikrowellen wird von metallfreien Phthalocyaninen ausgegangen die mit den Zink-, Magnesium-, Kobalt- oder Kupfer-Salzen von Essig- oder Chlorwasserstoffsäure umgesetzt werden. Als Produkt wird hierbei das entsprechende Metall-tetra-tert-butylphthalocyanin erhalten. Wichtig für die Reaktion ist ein Reaktionsgemisch frei von jeglichen organischen Lösungsmitteln. Metall-Phthalocyanin-Sandwichkomplexe (MPc2) können nur auf diese Weise hergestellt werden. Eine weitere Anwendungsmöglichkeit besteht in der Herstellung von CuPc durch die Umsetzung von Kupfer(I)-chlorid mit Harnstoff und Phthalsäureanhydrid unter Anwesenheit eines Katalysators. Die Ausbeute kann dabei durch die Verwendung höher-energetischer Mikrowellen erhöht werden.
Ultraschall
Reaktionen unter Ultraschall können bei Raumtemperatur durchgeführt werden. Die benötigte Zeit variiert dabei von einer Minute bis acht Stunden. Einerseits kann durch die Umsetzung von Phthalonitril mit Kupfer(I)-chlorid in einem geeigneten Lösungsmittel Kupfer-Phthalocyanin erhalten werden. Andererseits ermöglicht die Umsetzung von Kupfer(I)-chlorid mit Dichlorsilikon-Phthalocyanin-Monomeren und einem Natriumchalkogen den Aufbau von poly(phthalocyanato)-Siloxanen [Si(Pc)O]n.
Elektrosynthese
Das Verfahren der Elektrosynthese stellt ebenfalls eine Möglichkeit dar, bei Raumtemperatur Phthalocyanine darzustellen. Dabei wird unter anderem Phthalonitril an der Anode mit dem jeweiligen Metallsalz in alkoholischer Lösung an der Kathode zur Reaktion gebracht. So können unter Verwendung von Methanol Cu-, Ni-, Co- und der Mg-Phthalocyanin-Komplex hergestellt werden. Die Verwendung von Ethanol ermöglicht die Synthese des Pb-Phthalocyanins.
Bestrahlung (UV/VIS)
Die Bestrahlung des Reaktionsansatzes bestehend aus Phthalonitril in einem Alkohol in Anwesenheit von Natriummethanolat liefert bei Raumtemperatur PcH2.[10]
Bestrahlung (Laser)
Für die Herstellung von Kupfer-Phthalocyanin (CuPc) wird bei dieser Methode ein Kupfer-Target mit einem Laser beschossen. Die herausgeschlagenen Kupferatome können in einen dünnen Film aus 1,3-Diiminoisoindol eingebaut werden, wodurch CuPc erhalten wird.
Weitere Methoden
Neben den oben in Kürze beschriebenen Methoden bestehen unter anderem auch Möglichkeiten Synthesen bei relativ niedrigen Temperaturen (<100 °C) durchzuführen. Diese überschneiden sich thematisch mit den Elektrosynthesen. Weiterhin ist es möglich, unter anderem auch durch Bestrahlung oder elektrochemische Methoden Phthalocyanin-Radikale herzustellen die unter Luftsauerstoff stabil sind. Als letzte Methode soll, der Vollständigkeit halber, die Darstellung von Phthalocyanin-Komplexen unter Verwendung von radioaktiven Elementen oder radioaktiver Isotope stabiler Elemente genannt werden.
Verwendung
Phthalocyanine finden Anwendung als Farbstoff (Dye) auf optischen Datenträgern (CD-R) und als Pigmente für Kunststoffe, Lacke und in der Papierindustrie. Außerdem können sie als Photoleiter in Laserdruckern oder als Elektrodenmaterial in Brennstoffzellen dienen. In der chemischen Forschung wird Phthalocyanin als leicht herstellbare Modellsubstanz für die biologisch wichtigen Porphyrine verwendet. Des Weiteren finden Phthalocyanin-Derivate Anwendung in der Photodynamischen Therapie.[11] Bei dieser werden Phthalocyanine im Tumorgewebe angereichert und durch Licht (Wellenlänge 600–800 nm) angeregt, wodurch reaktiver Singulett-Sauerstoff freigesetzt wird. Durch die damit verbundenen Folgereaktionen tritt innerhalb weniger Stunden durch Nekrose und Apoptose der Zelltod ein, was im Idealfall nach 4–6 Wochen zur totalen Auflösung des Tumors führt.
Phthalocyanin-Derivate
- Aluminiumphthalocyanin, CAS-Nummer: 14154-42-8
- Nickelphthalocyanin, CAS-Nummer: 14055-02-8
- Kobaltphthalocyanin, CAS-Nummer: 3317-67-7
- Eisenphthalocyanin, CAS-Nummer: 132-16-1
- Zinkphthalocyanin, CAS-Nummer: 14320-04-8
- Kupferphthalocyanin
- Polychlorkupferphthalocyanin
- Hexadecachlorphthalocyanin, CAS-Nummer: 28888-81-5
- Hexadecabromphthalocyanin, CAS-Nummer: 28746-04-5
- Manganphthalocyanin, CAS-Nummer: 14325-24-7
Einzelnachweise
- Eintrag zu CI 74100 in der CosIng-Datenbank der EU-Kommission, abgerufen am 6. Juli 2020.
- Datenblatt Phthalocyanine bei AlfaAesar, abgerufen am 6. Dezember 2019 (PDF) (JavaScript erforderlich).
- Datenblatt 29H,31H-Phthalocyanine, β-form, 98% bei Sigma-Aldrich, abgerufen am 6. Dezember 2019 (PDF).
- The Phthalocyanines – Vols 1-4 Edited by C. C. Leznoff and A. B. P. Lever, Wiley 1986–1993.
- Neil B. McKeown: Phthalocyanine Materials - Synthesis, Structure and Function, Cambridge University Press 1998.
- The Porphyrin Handbook, Vols. 15–20; Karl Kadish, Kevin M. Smith, Roger Guilard (eds); Academic Press 2003.
- A. Braun, J. Tcherniac: "Über die Produkte der Einwirkung von Acetanhydrid auf Phthalamid", in: Berichte der Deutschen Chemischen Gesellschaft, 1907, 40 (2), S. 2709–2714; doi:10.1002/cber.190704002202.
- H. de Diesbach, E. von der Weid: "Quelques sels complexes des o-dinitriles avec le cuivre et la pyridine", in: Helvetica Chimica Acta, 1927, 10 (1), S. 886–888; doi:10.1002/hlca.192701001110.
- Peter Kredel: Herstellung und Verwendung von PCB in der chemischen Industrie. In: Gefahrstoffe – Reinhalt. Luft. 71, Nr. 1/2, 2011, ISSN 0949-8036, S. 7–9.
- B. I. Kharisov, U. Ortiz Méndez, J. L. Almaraz Garza, J. R. Almaguer Rodríguez: "Synthesis of non-substituted phthalocyanines by standard and non-standard techniques. Influence of solvent nature in phthalocyanine preparation at low temperature by UV-treatment of the reaction system", in: New J. Chem., 2005, 29, S. 686–692; doi:10.1039/b415712p.
- A. Hirth, U. Michelsen, D. Wöhrle: Photodynamische Tumortherapie, in: Chemie in unserer Zeit, 1999, 33 (2), S. 84–94; doi:10.1002/ciuz.19990330204.
Weblinks
- Phthalocyanin Verbindungen (englisch).
- Society of Porphyrins and Phthalocyanines (englisch).
- Sir Patrick Linstead: Phthalocyanines (Video).