Kupfer(II)-bromid
Kupfer(II)-bromid ist ein Kupfersalz des Bromwasserstoffs mit der Verhältnisformel CuBr2. Kupfer besitzt hier die Oxidationsstufe +2.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
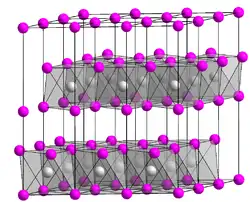 | ||||||||||||||||
| _ Cu2+ _ Br− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kupfer(II)-bromid | |||||||||||||||
| Andere Namen |
Kupferdibromid | |||||||||||||||
| Verhältnisformel | CuBr2 | |||||||||||||||
| Kurzbeschreibung |
zerfließliche schwarze geruchlose Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 223,36 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,71 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
900 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,1 mg/m3[1] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Kupfer(II)-bromid kann aus den Elementen gewonnen werden.
Ebenfalls möglich ist Herstellung aus Kupfer(II)-oxid und Bromwasserstoffsäure bzw. Kupfer(II)-chlorid und Bor(III)-bromid.[3]
Eigenschaften
Kupfer(II)-bromid ist ein grünlicher-schwarzer und hygroskopischer Feststoff, der eine grüne Flammenfärbung hervorruft. Er ist für die grüne Flamme einer positiven Beilstein-Probe verantwortlich, bei der Kupfer(II)-bromid nach obiger Reaktion gebildet wird. Es kristallisiert in der Cadmiumiodid-Struktur. Beim Erhitzen zersetzt sich Kupfer(II)-bromid unter Abgabe von Brom zu Kupfer(I)-bromid:[4]
Es besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12), a = 7,18 Å, b = 3,46 Å, c = 7,14 Å, β = 121° 15′ und eine Bildungsenthalpie von −139,7 kJ/mol.[3]
Löslichkeit[5]
Kuper(II)-bromid ist in Wasser relativ gut löslich. Bei Temperaturen unter 18,0 °C kristallisiert Kuper(II)-bromid als grünes Tetrahydrat in Form monokliner Prismen aus, darüber in der wasserfreien Form als schwarze Rhomboeder.
| Temperatur in °C | 0,0 | 5,75 | 9,9 | 15,0 | 20,0 | 25,0 | 30,1 | 34,8 | 50,0 |
| Löslichkeit in g/L | 518 | 528 | 537 | 550 | 559 | 558 | 561 | 560 | 568 |
Verdünnte Lösungen sind blau, konzentrierte grün bis dunkelbraun.[6]
Verwendung
In der organisch-chemischen Synthese können Ketone mit Kupfer(II)-bromid zu α-Bromketonen bromiert werden.[7]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
Einzelnachweise
- Eintrag zu Kupfer(II)-bromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 977.
- C. Rammelsberg: Über Brommetalle und ihre Verbindungen mit Ammoniak. In: Annalen der Physik. Vol. 131, Nr. 55, 1842, S. 237–253 (Artikel).
- Sydney Raymond Carter, Norman Joseph Lane Megson: A phase rule investigation of cupric bromide in aqueous and hydrobromic acid solutions. In: Journal of the Chemical Society. 1928, S. 2954–2967, doi:10.1039/JR9280002954.
- J. H. Gladstone: On the Chemical Action of Water on Soluble Salts. In: Proceedings of the Royal Society of London. Vol. 9, 1857, S. 66–70, JSTOR:111442.
- L. Carroll King, G. Kenneth Ostrum: Selective Bromination with Copper(II) Bromide1. In: The Journal of Organic Chemistry. Band 29, Nr. 12, Dezember 1964, S. 3459–3461, doi:10.1021/jo01035a003.

