Überkritische Trocknung
Die überkritische Trocknung ist ein physikalisches Verfahren zur kontrollierten und präzisen Abtrennung von Flüssigkeiten aus Feststoffen. Wie auch bei der Gefriertrocknung macht man sich dabei das Phasenverhalten eines Stoffes zunutze, um die Trocknung mittels Verdampfung bzw. Verdunstung zu umgehen. Der Ausdruck überkritisch bezieht sich dabei auf die Druck- und Temperaturbedingungen, die im Verfahren oberhalb des kritischen Punktes liegen.
Der Prozess wird bei Herstellungsverfahren in der Mikrosystemtechnik, zur Trocknung von Gewürzen und bei der Produktion von unter anderem Aerogelen über den Sol-Gel-Prozess eingesetzt. Proben für die Rasterelektronenmikroskopie, speziell biologische Proben, werden so getrocknet, um Artefaktbildungen, die bei anderen Trocknungsprozessen auftreten können, zu vermeiden.
Thermodynamische Grundlagen
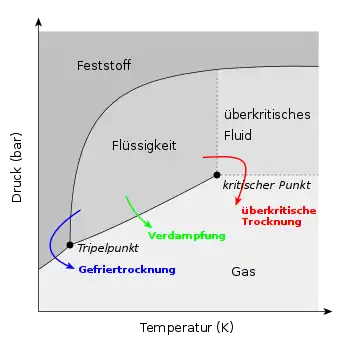
Jeder Stoff hat ein durch sein Phasendiagramm bestimmtes Phasenverhalten, das heißt eine Neigung bei bestimmten Bedingungen seine Phase zu ändern. Die Bedingungen, bei denen es zu solchen Phasenumwandlung kommt, sind bei Reinstoffen durch Druck und Temperatur eindeutig bestimmt. Für die überkritische Trocknung ist die Phasenumwandlung von einer Flüssigkeit zu einem Gas entscheidend, die durch dieses Verfahren jedoch gerade vermieden werden soll. Es kommt bei einer solchen als Verdampfen bezeichneten Phasenumwandlung zu einer Zerstörung feinporöser Strukturen durch die Zunahme der Oberflächenspannung und der damit einhergehenden Wirkung der Kapillarkräfte. Will man aber sehr feingliedrige Strukturen mit rund über 75 % Porosität trocknen, so muss man diesen Prozess vermeiden.
Problematik einer unterkritischen Trocknung
Lässt man das Lösungsmittel bei Raumtemperatur verdunsten bzw. im Ofen verdampfen, so kommt es zu einer Reihe von Effekten, die sich bei sehr feinstrukturierten Materialien als problematisch erweisen. Das Lösungsmittel fängt an der Oberfläche an zu verdunsten und führt dabei insbesondere bei Gelen zu einer dem Volumen des Lösungsmittels entsprechenden Schrumpfung. Gleichzeitig strömt Lösungsmittel aus dem Inneren des Körpers nach. Es kommt zu einer Verformung der labilen Feinstrukturen und im Extremfall führt der wirkende Druckgradient auch bereits zu Rissen im Material. Ist das Netzwerk schließlich zu steif, um weiter zu schrumpfen, fangen die Poren an, beginnend mit den größten, sich zu entleeren. Je größer die Porenradien und je geringer ihre Unterschiede dabei sind, desto geringer ist die Wahrscheinlichkeit einer Zerstörung der Feinstruktur. Bei geschlossenen Poren wirken Diffusionsprozesse. Der Flüssigkeitsfilm an den Wänden der Poren bleibt am längsten bestehen. Resultat eines solchen Prozesses ist im Fall eines Gels ein Xerogel, bei beispielsweise kleinsten Bauteilen deren Zerstörung.
Verfahren

Grundprinzip ist, dass man den Stoff zunächst vom flüssigen in den überkritischen Zustand versetzt und hiernach bei konstanter Temperatur den Druck auf den Umgebungsdruck überführt. Eine Phasengrenze passiert man dabei im Unterschied zur unterkritischen Trocknung und auch Gefriertrocknung nicht, da eine Unterscheidung zwischen Gas und Flüssigkeit nicht möglich ist. Es treten daher im Unterschied zur unterkritischen Trocknung auch keine Kapillarkräfte auf.
Für das Verfahren eignen sich besonders die Fluide Kohlenstoffdioxid und Freon, wobei Letzteres jedoch nicht mehr erhältlich ist. Distickstoffmonoxid hat ähnliche Eigenschaften wie Kohlenstoffdioxid, ist in seinem überkritischen Zustand jedoch ein starkes Oxidationsmittel. Es wird je nach den kritischen Temperaturen des Lösungsmittels zwischen „heißer“ (organische Lösungsmittel) und „kalter“ (Kohlenstoffdioxid) überkritischer Trocknung unterschieden. Die mit über 250 °C und 5 bis 8 MPa hohen Ansprüche an die Gerätetechnik und auch die möglichen Veränderungen an nicht hitzresistenten Trockengüter haben die überkritische Trocknung mit Kohlenstoffdioxid bei 31 °C und 7,375 MPa zum dominierenden Standardverfahren gemacht.
Kohlenstoffdioxid ist jedoch nicht mit Wasser oder Ethylenglycol mischbar, sondern nur mit Methanol, Ethanol oder Aceton. Besonders bei der Herstellung von Aerogelen über den Sol-Gel-Prozess hat dies aufwendige Austauschprozesse des ursprünglichen Precursor-Lösungsmittels gegen in der Regel Aceton zur Folge. Dieser diffusionsbasierte Austausch ist von der Größe des zu trocknenden Körpers abhängig und benötigt bei einer Dicke von 10 mm bereits acht Stunden.
In der Folge wird das Aceton bei 8 °C und etwa 60 bar in einem Autoklaven gegen flüssiges Kohlenstoffdioxid ausgetauscht. Nach mehrmaliger Wiederholung dieses Schrittes bis zur vollständigen Entfernung des Acetons wird der Autoklav über den kritischen Punkt des Kohlenstoffdioxids gebracht und eine Stunde hier gehalten. Der Druck wird hiernach über ein Ventil reduziert, bis der Umgebungsdruck erreicht ist und das Trockengut entnommen werden kann.
Historisches
Eine erste Beschreibung des Verfahrens stammt aus dem Anfang der 1930er Jahre von Steven Kistler (Samuel Stephens Kistler; 1900–1975).
Literatur
- S. S. Kistler: Coherent expanded aerogels and jellies. Nature, 127, S. 741ff. (1931), ISSN 0028-0836
- S. S. Kistler: Coherent expanded aerogels. Journal of Physical Chemistry, 36(1), S. 52–64 (1932), ISSN 1520-6106
- Markus Meyer: Synthese und Charakterisierung neuartiger Silica-Gele. (Dissertation der Universität Bayreuth) GCA Verlag Herdecke 2004, ISBN 3-89863-169-9 (Hauptquelle)