Samarium(III)-chlorid
Samarium(III)-chlorid ist eine chemische Verbindung aus der Gruppe der Chloride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
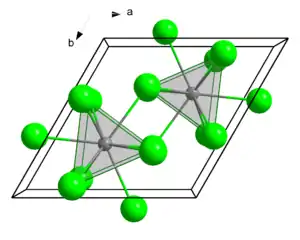 | ||||||||||||||||
| _ Sm3+ _ Cl− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
P63/m (Nr. 176) | |||||||||||||||
| Koordinationszahlen |
Sm[9], Cl[3] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Samarium(III)-chlorid | |||||||||||||||
| Andere Namen |
Samariumtrichlorid | |||||||||||||||
| Verhältnisformel | SmCl3 | |||||||||||||||
| Kurzbeschreibung |
weißes bis gelbliches hygroskopisches Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 256,72 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser (938 g·kg−1 bei 25 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Samarium(III)-chlorid kann als Lösung durch Reaktion von Samarium oder Samarium(III)-carbonat mit Salzsäure gewonnen werden. Bei Reaktion mit Chlorwasserstoff entsteht die wasserfreie Form.[5][6]
Es kann auch direkt aus den Elementen synthetisiert werden.[5][6]
Eigenschaften
Samarium(III)-chlorid ist ein weißes bis gelbliches hygroskopisches Pulver. Es besitzt eine hexagonale Kristallstruktur mit der Raumgruppe P63/m (Nr. 176). Das Hexahydrat bildet topasgelbe Tafeln und besitzt eine monokline Kristallstruktur mit der Raumgruppe P2/n (Nr. 13, Stellung 2). Bei 110 °C gibt es Kristallwasser ab.[1]
Verwendung
Samarium(III)-chlorid wird häufig als Ausgangsmaterial zur Herstellung von reinem Samarium durch Elektrolyse einer geschmolzenen Mischung mit Natriumchlorid und Calciumchlorid verwendet.[7] Es kann auch in der organischen Chemie zum Beispiel für Cyclisierungen verwendet werden.[8]
Einzelnachweise
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 2007, ISBN 978-3-540-60035-0, S. 634 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Samarium(III) chloride, anhydrous, powder, 99.9% bei Sigma-Aldrich, abgerufen am 26. April 2012 (PDF).
- Datenblatt Samarium(III) chloride hexahydrate, ≥99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 26. April 2012 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 89. Auflage. (Internet-Version: 2009), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-86.
- L. F. Druding, J. D. Corbett: Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide. In: J. Am. Chem. Soc. Vol. 83, Nr. 11, 1961, S. 2462, doi:10.1021/ja01472a010.
- J. D. Corbett: ? In: Rev. Chim. Minerale. Vol. 10, 1973, S. 239.
- Rareearthproducts: Samarium (Memento vom 21. Juli 2011 im Internet Archive)
- Michael Schmittel, Marc Strittmatter: Cyclization of carbonyl substituted enyne-allenes: C2-C6-cyclization induced by heat or by addition of samarium(II) iodide, samarium(III) chloride, or boron trifluoride. In: Tetrahedron. Band 54, Nr. 45, 5. November 1998, S. 13751–13760, doi:10.1016/S0040-4020(98)00847-3.
