Feststoff-Bioreaktor
Feststoff-Bioreaktoren (englisch Solid State Fermentation-Bioreactors; SFB) sind Bioreaktoren, die zur Kultur von Mikroorganismen und zur industriellen Herstellung von Enzymen, Medikamenten und Nahrungsmitteln genutzt werden.
Probleme bei der Auslegung der Feststoff-Bioreaktoren ergeben sich durch die Limitierungen bei Sauerstoffversorgung sowie der Ventilation von überschüssigem CO2, die zu nicht tolerierbaren Temperaturgradienten, Austrocknen und der irreversibler Schädigung der Kultur führen.
Durch Beimengung geeigneter Füllkörper lässt sich die tolerierbare Schichtdicke und damit die Raum-Zeit-Ausbeute des Reaktors steigern.
Generell wird zwischen stationären und instationären Bioreaktoren unterschieden. Zu den stationären Reaktoren gehören unter anderem Petrischalen, Fernbach-Kolben, hölzerne Inkubatoren, der Covered Pan-Bioreaktor sowie Säulen-SSF-Bioreaktoren (englisch Solid State Fermentation, SSF, Feststoff-Fermentation). Zu den instationären Reaktoren zählt man die Rotary-Drum-SFB, der gerührte SFB sowie der Taumel-SFB.
Geschichte
Während die Feststoff-Fermentation in den westlichen Ländern seit ihrer späten Entdeckung zu Anfang des 20. Jahrhunderts vernachlässigt wurde, erlebte sie in den fernöstlichen Ländern nach dem Zweiten Weltkrieg eine stetige Aufwärtsentwicklung hin zu vollautomatischen industriellen Prozessen mit einem geschätzten Marktvolumen von 8–10 Milliarden $/Jahr. Dabei ist die SSF nicht nur für die klassischen ostasiatischen Applikationen, wie der Herstellung von Enzymen und Nahrungs- und Würzmitteln von Interesse, sondern auch für
- neuartige Antibiotika
- antikarzinogene Substanzen
- Antioxidantien
- Aromen
- Duftstoffe
- „Health Food“
- hypocholesterinemische Agenzien
- Starterkulturen
- mit Proteinen angereichertes Tierfutter
- thrombolytische Enzyme
- vasoaktive Agenzien
- Vitamine etc.
Das klassische Verfahren zur Massenkultur von Schimmelpilzen durch SSF ist seit Jahrtausenden, vor allem in fernöstlichen Ländern, die stationäre Kultur in perforierten Tabletts, die wenige Zentimeter hoch mit dem beimpften Substrat befüllt werden.
In den ostasiatischen Ländern, vor allem Japan, erfolgte eine Maßstabsvergrößerung der SSF in den vollständig automatisierten industriellen Maßstab mit Kapazitäten von mehr als 100 t beimpftes Substrat pro SSF-Bioreaktor (SFB). Bei einer um den Faktor fünf bis sieben größeren Substratkapazität entspricht dies der Leistung eines Submers-Bioreaktors mit einem Arbeitsvolumen zwischen 700 und 1000 m³. Die Erkenntnis wesentlicher ökonomischer und verfahrenstechnischer Vorteile der SSF gegenüber der Submersfermentation (STF) führte, vor allem in den USA seit den siebziger Jahren, zu einer Wiederbelebung der Forschungsaktivitäten auf dem Gebiet der SSF.
Der Durchbruch zu einer großtechnischen Nutzung dieses vergleichsweise einfacheren und kostengünstigeren Verfahrens ist jedoch abhängig von der Verfügbarkeit automatisierter SSF-Bioreaktoren im industriellen Maßstab, das heißt, mit Kapazitäten oberhalb von 10 t an beimpftem Substrat.
Im Folgenden wird ein Überblick über die bis heute eingesetzten SSF-Bioreaktoren gegeben. Deren Einteilung erfolgt, je nachdem ob das inokulierte Substrat während der Fermentation bewegt wird oder nicht, in stationäre und instationäre Verfahren.
Stationäre SSF-Bioreaktoren
Bei den stationären Verfahren der SSF wird das Substrat während der Fermentation entweder überhaupt nicht oder nur in der Mitte der Fermentation, ein- bis zweimal, umgewälzt.
Petrischalen
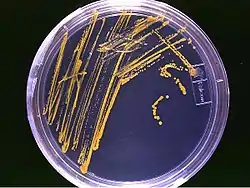
Petrischalen mit 20–30 g feuchtem Substrat in dünner Schicht sind der erste Schritt zur Kultivierung von Schimmelpilzen auf festen Substraten. Die Beimpfung erfolgt von einer Agarplatte durch Übertragung von sterilem Substrat auf die sporulierte Kultur. Die Platte wird zur gleichmäßigen Verteilung von Sporen und Luftmycel auf der Oberfläche der Substratpartikel geschüttelt. Die Petrischale wird unter geeigneten Bedingungen in Brutschränken bis zur Sporulation inkubiert. Der dicht durchwachsene, kompakte Kuchen wird getrocknet vermahlen und dient als Inokulum (die Menge an Zellen, mit denen ein Fermenter angeimpft wird), für die Anzucht in größeren, flachen Schalen mit zirka 200 g inokuliertem Substrat. Sämtliche Manipulationen erfolgen unter aseptischen Bedingungen. Diese Methode ist einfach, sicher und preiswert.
Fernbach-Kolben
Fernbachkolben werden ausschließlich für SSF im kleinen Labormaßstab eingesetzt. So werden zum Beispiel 70 g Weizenkleie eingeweicht und mit Wattestopfen oder Kappen verschlossen. Die Kolben werden autoklaviert. Das Inokulum wird durch intensives Schütteln mit dem Substrat vermischt, die Kolben anschließend stationär inkubiert. Petrischalen und Fernbach-Kolben sind wegen des Fehlens einer Möglichkeit zur Belüftung, Befeuchtung, Entfernung von überschüssigem CO2 sowie wegen der daraus resultierenden geringen Substratkapazitäten nur für erste Schritte im Labor geeignet. Beide Methoden sind relativ arbeitsaufwändig und ungeeignet für ein Scale-up.
Hölzerne Inkubatoren
Zur Steigerung der Substratkapazität wurden deshalb in den USA seit zirka 1938 und während des Zweiten Weltkriegs zur Herstellung von Aflatoxinproduktion im beabsichtigten großen Maßstab hölzerne Inkubatoren von 27 L Volumen zur Aufnahme von 4,5 kg Weizenkleie mit einer Schichtdicke von 25 cm[1] entwickelt. Der Bioreaktor besaß Vorrichtungen für Be- und Entlüftung mit Umkehrung der Strömungsrichtung, Temperatur-, Druckanzeige sowie eine temperierbare Luftbefeuchtung.
Die mit diesen Bioreaktoren erhaltenen Ergebnisse waren schlechter als die in flacher Schicht. Die Ursachen waren ungleichmäßige Belüftung, Ventilation, Befeuchtung sowie Temperaturgradienten von 30 bis 50 °C infolge bevorzugter Strömungskanäle innerhalb der Packung. Die Ergebnisse wurden als Basis für weitere Entwicklungen angesehen. Versuche zum Scale-Up in den halbtechnischen Maßstab mit Substratkapazitäten bis 1 t ergaben noch mäßigere Ergebnisse. Immerhin war das Wachstum auf weitaus niedrigerem Niveau als in dünner Schicht, reproduzierbar.[2] Versuche zu einer Steigerung der Schichtdicke bei gleichzeitiger Verringerung des Durchmessers misslangen vollständig.[1] Die Ergebnisse mit vergrößerten Schichtdicken waren so eindeutig negativ, die Ursachen für die Misserfolge so offenkundig, dass sich, rückschauend, bereits in den vierziger Jahren und erst recht später, weitere Versuche, die Kapazitätsrate durch Steigerung der Schichtdicke zu erhöhen, erübrigt hätten.
Covered Pan-Bioreactor (Pot Method)
Zu Beginn der 1940er Jahre wurden große Mengen an Inokulum für die SSF in Rotary Drum Bioreaktoren benötigt. Alternativ zu den hölzernen Inkubatoren wurden geschlossene, flache Pfannen mit den Maßen 61 × 61 × 10 cm (Totalvolumen zirka 37 l) entwickelt. Die Luftzuführung erfolgte im Zentrum des Deckels, die Abluftausgänge in den vier Ecken nahmen ihren Ursprung aus der Tiefe der Substratpackung. Hierdurch sollte eine Zwangsdurchströmung des Substrates gewährleistet werden. Die Kapazität betrug zirka 4 kg inokuliertes Substrat. Die Schichtdicke durfte 1 cm nicht überschreiten, da ansonsten Sauerstofflimitierung stattfand. Die Kapazitätsrate (w/v) betrug weniger als 10 %. Diese Methode war der in rotierenden Drehtrommel-Bioreaktoren (Rotating Drum Bioreactors) überlegen[3], Wachstum, Enzymbildung und Sporulation waren weitaus intensiver. Die Einrichtung war weniger aufwändig zu betreiben als die Rotary Drum Bioreaktoren. Außerdem war das Mycel während des Wachstums nicht, wie in den Rotary Drum-Bioreaktoren, einer ständigen Scherbelastung unterworfen, die zu einer starken Verzögerung des Wachstums bei erheblich verlängerter Fermentationsdauer und signifikant verringerten Enzymausbeuten führte.
Eine kleinere Variante bestand aus einer runden Aluminium-Kasserolle (15 cm Durchmesser und 11,3 cm Höhe, Totalvolumen zirka 2 l), deren Boden perforiert war. Die Kapazität betrug zirka 750 g feuchte Weizenkleie (Kapazitätsrate 38 %, w/v). Der Bioreaktor besaß Vorrichtungen für Be- und Entlüftung, Umkehr der Strömungsrichtung und Temperaturkontrolle. Befeuchtung des Substrates, Sterilisation, Inokulation mit Aspergillus oryzae (0,6–1 %, w/w), Inkubation (30 °C) usw. wurden in situ durchgeführt. Belüftung, Ventilation von überschüssigem CO2, Befeuchtung und Temperierung wurden mit angefeuchteter, temperierter Luft durchgeführt. Vergleiche dieses Typs mit Rotary Drum-Bioreaktoren ergaben eine Reihe von Vorteilen für das stationäre Verfahren: weniger Platzbedarf, gleichmäßigeres Wachstum, besser reproduzierbare und höhere Enzym-Ausbeuten, Verzicht auf Vorrichtungen zur Umwälzung des fermentierenden Substrates. Auch hier wurde der negative Effekt der Scherbelastung in Rotary Drum-Bioreaktoren auf Wachstum, Ausbeute und Prozessdauer hervorgehoben. Ein Nachteil der Covered Pan Bioreactors war jedoch, dass diese Methode wegen ungleichmäßiger Belüftung bei Maßstabsvergrößerung nicht Scale-Up-fähig, zu arbeitsaufwändig und daher für die industrielle SSF nicht geeignet war.
SSF in flachen Tabletts (Shallow Layer Tray Method)
Der traditionelle Koji-Prozess zur Produktion von Enzymen auf Sojabohnen in Japan verwendet flache Tabletts (Schichtdicke bis zirka 4 cm) aus Holz, Aluminium oder rostfreiem Stahl mit perforiertem Boden (Löcher mit zirka 3 mm Durchmesser in Abständen von zirka 2,5 cm), in denen das mit Aspergillus oryzae inokulierte Substrat zirka 3 Tage/30 °C inkubiert wird. Die Tabletts werden in klimatisierten Räumen übereinander mit lichten Abständen von zirka 10 cm gestapelt. Die Schichtdicke des inokulierten Substrates darf bei Kulturen mit einer Fermentationsdauer von mehr als 48 h 4 cm nicht überschreiten.
Bei rasch wachsenden Kulturen (15–24 h) liegt die maximale vernünftige Schichtdicke bei 2–3 cm. Bei höheren Schichtdicken wachsen die äußeren (oben und unten) 1–2 cm einwandfrei, während innerhalb davon die Temperaturen derart hohe Werte (bis zirka 57 °C) erreichen, dass das Mycel nach geringem anfänglichen Wachstum irreversibel inaktiviert wird und autolysiert. Tabletts für den Labor- und Pilot-Maßstab werden üblicherweise manuell gehandhabt. Sie haben daher aus Gewichtsgründen Abmessungen von zirka 50 × 60 × 2–4 cm³ (6–12 l Volumen) mit einer Substratkapazität von, je nach Schichtdicke, 4–8 kg inokuliertes Substrat. Bei Stahlblechen (18/10) beträgt das Gesamtgewicht nach Befüllung zwischen 8–12 kg. Tabletts für gewerbliche Produktion haben Abmessungen von zirka 150 × 500 × 2–4 cm³ (150–300 l Volumen) mit einer Kapazität bis zirka 200 kg inokuliertes Substrat. Diese Tabletts werden automatisch befüllt, entleert, gereinigt und sterilisiert. Nach Inokulation werden die Tabletts, zur Verbesserung der Ventilation vorzugsweise 10–15° geneigt[4] [5] [6][7], in Stapeln mit, in Abhängigkeit von der Ventilation unterschiedlichen lichten vertikalen Abständen bis hinab auf 2 cm, übereinander angeordnet und unter definierten Bedingungen (Temperatur, Feuchtigkeit, Belüftung) inkubiert. Ungeachtet des gewünschten Produktes ist die Überwachung weiterer Faktoren in der Regel überflüssig. Der wesentliche Vorteil der Tablett-Methode sind ihre Einfachheit, Unanfälligkeit gegenüber Störungen, ausgezeichneten Ergebnisse und Reproduzierbarkeit.[1] [8][9] Die vollautomatischen japanischen Anlagen, die zum Teil seit den sechziger Jahren in Betrieb sind, besitzen Kapazitäten von zirka 30 bis zu einigen hundert t Substrat pro Tag mit kontinuierlicher Prozessführung.
Moderner SSF-Bioreaktor im Pilot-Maßstab
Ein moderner SSF-Bioreaktor zur Inkubation flacher Tabletts hat eine variablen Substratkapazität abhängig von der Zahl der inkubierten Tabletts von <1 bis 240 kg. Die Tabletts enthalten das inokulierte Substrat in dünner (2–4 cm) Schicht. Sie befinden sich, zur Verbesserung der Ventilation zirka 10° geneigt, in Gestellen mit lichten vertikalen Abständen zwischen den Tabletts von zirka 2 cm. Definiert temperierte und befeuchtete Luft strömt in einer gerichteten Zwangsströmung durch eine seitliche Öffnung im Bodenbereich des Reaktorinnenraumes über Ober- und Unterseite der Tabletts. Im Kopfraum des Bioreaktors wird der Luftstrom durch einen Ventilator angesaugt und in einer Schlaufe an der Rückseite des Bioreaktors in einer abwärts gerichteten Zwangsströmung dem Bodenbereich zugeführt. Dabei passiert er großflächige Wärmetauscher, und frisch konditionierte Luft wird zugeführt.
Die maximale Kapazitätsrate beträgt 25–30 % (w/v = 70 %, Volumenanteil). Wegen der variablen Substratkapazität dieses SSF-Bioreaktors lassen sich die mit zum Beispiel 200 g Substrat erhaltenen Ergebnisse problemlos in einem Schritt auf dessen volle Kapazität von 240 kg übertragen. Ausgezeichnete Ergebnisse werden bei vergleichsweise signifikant kürzeren Fermentationszeiten erhalten. Das Preis/Nutzen-Verhältnis (Eur/kg Fermentationskapazität) fällt, je nach Ausstattung, von kleineren auf zirka ein Viertel der Kosten für Bioreaktoren größerer Kapazität.[6] [7]
Automatisierte Anlagen (Conveyor Bioreactor)
Automatische Anlagen wurden schon vor Jahrzehnten in den USA für den Produktionsmaßstab entwickelt.[10] Sie umfassen sämtliche Schritte einer kontinuierlichen SSF: Einweichen des Substrates, Sterilisation, Abkühlen, Beimpfen, Verteilen auf den Tabletts, Stapeln der Tabletts, Inkubation, Downstream Processing, Reinigen sowie Sterilisieren der gereinigten Tabletts. An diesem Prinzip hat sich bis heute nichts Wesentliches geändert.
Industrielle Anlagen
Industrielle, automatisierte Anlagen werden in japanischen Unternehmen für die Produktion von Enzymen, Nahrungs- und Würzmitteln seit den sechziger Jahren betrieben. Kontinuierliche Kocher, automatische Inokulatoren, Mischer, rechteckige (5,4 × 60 × 0,6 m³) Wannen mit perforierten Wänden und Boden (Totalvolumen zirka 190 m³) mit Kapazitäten von bis zu 100 t inokuliertes Substrat/Wanne und Ansatz, aufgestellt in geschlossenen Räumen mit automatischer Zwangsbelüftung, Temperatursteuerung sowie Vorrichtungen zur vereinzelten Umwälzung des fermentierenden Substrats. Die beimpfte Masse wird auf die perforierten Wannen verteilt, und konditionierte Luft zirkuliert durch das Substrat. Nach 48 bis 72 Stunden wird das fertige Koji (Aspergillus oryzae) geerntet und die Enzyme extrahiert.[11] Da das Umwälzen zum Aufbrechen der Aggregate zu einer mehrstündigen Wachstumsverzögerung führt, wird dieser Vorgang auf ein-, maximal zweimal während der Fermentationsdauer begrenzt. Die Verzögerung lässt sich auf 8–12 h beziffern.
Enzyme werden von Aspergillus oryzae innerhalb eines verhältnismäßig breiten, überwiegend suboptimalen physiologischen Spektrums (26–42 °C in der Packung, 35–52 % {w/w} Substratfeuchte, 10–100 % Sättigung des Sauerstoffbedarfs, CO2-Gehalte von bis zu 21 % in der Atmosphäre) produziert. Insofern lassen sich Enzyme in SSF mit Aspergillus oryzae bei entsprechend geeigneter Prozessführung auch in relativ hoher Schicht (gegebenenfalls Zumischung geeigneter Spacer) mit guter Ausbeute erzeugen.
Demgegenüber sind die Optima, insbesondere der optimale Grad der Sättigung des Sauerstoffbedarfs, für die Produktion anderer Metaboliten wesentlich schmaler. Hierdurch werden die Schichtdicken zur Vermeidung von Gradienten stärker als im Fall der Enzymproduktion begrenzt.
SSF in Hoher Schicht (High-Heap Method)
Verschiedene Anstrengungen zur Vergrößerung der Schichtdicke wurden unternommen, um die Kapazitätsrate zu verbessern. Dabei ging man bis zu einer Schichtdicke von 1,5 m. In einem der ersten SSF-Prozesse großer Schichtdicke (High-Heap) wurde das feuchte sterilisierte Material mit porösen Füllkörpern wie Reisspelzen gemischt, inokuliert und in einen Behälter mit perforiertem Boden gefüllt, durch den konditionierte Luft gepresst wurde.[12]
Zur Produktion von Citronensäure mit Aspergillus niger wurde verdünnte Melasse mit Reis- oder Weizenkleie vermischt, 30 min auf 90–95 °C erhitzt, auf unter 40 °C gekühlt und nach dem Beimpfen zur Erzeugung einer porösen Struktur mit vorsterilisierten Sägespänen oder Reisspelzen vermischt. Feuchtigkeitsgesättigte, temperierte (30 °C) Luft wurde durch die Packung gepresst. Während der lag-Phase wurde das Substrat mit durch Kühlschlangen geleitetem, auf 33 °C erwärmtem Wasser temperiert.[13] Die Ausbeuten an Citronensäure waren in SSF höher als in Oberflächenkultur oder in Submersfermentation (STF).[14]
Ein Labor-SSF-Bioreaktor mit quadratischem Grundriss (30 × 30 × 25 cm³, 22,5 l Totalvolumen), perforiertem Boden und Deckel für Zu- und Abluft, mit einer Substratkapazität von zirka 9 kg (Kapazitätsrate 40 %, w/v) ergab zufriedenstellende, wenn auch mit der Tablett-Methode nicht vergleichbare, Ergebnisse.[1] Konditionierte Pressluft wurde benötigt, um die während der SSF erforderliche Frischluft, Feuchtigkeit, Ventilation von CO2 sowie Oxidationswärme zu gewährleisten. Mit fortschreitendem Wachstum verstopften die interpartikulären Räume durch Mycel, bis das Wachstum trotz Erhöhung des Vordrucks zum Erliegen kam. Trotz der, verglichen mit den Ergebnissen der Tablett-Methode, mäßigen Ergebnisse wurde ein Scale-Up dieses Typs mit weiterer Erhöhung der Schichtdicke versucht. Die Ergebnisse erwiesen sich jedoch als vollständiger Fehlschlag. Hierfür waren verschiedene Gründe ausschlaggebend: Die hauptsächliche Ursache war, dass der Druckverlust (>1 bar) bei fortschreitendem Wachstum, insbesondere infolge der relativ langen Diffusionswege, trotz Druckerhöhung nicht kompensiert werden konnte, wodurch Belüftung, Befeuchtung und Ventilierung nicht in adäquatem Rahmen aufrechterhalten werden konnten. Daraufhin überhitzte sich das fermentierende Substrat, trocknete in kurzer Zeit aus, und das Mycel wurde irreversibel geschädigt. Zufriedenstellendes Wachstum wurde lediglich in einem räumlich auf die nähere Umgebung der Lufteintrittsöffnung begrenzten Bereich gefunden.
Diese eindeutigen Fehlschläge bewiesen, dass ohne die Zuhilfenahme poröser Spacer eine Steigerung der Schichtdicke nur innerhalb sehr enger Grenzen zu zufriedenstellenden Ergebnissen führte. Dies wurde in den späteren Jahrzehnten wiederholt unfreiwillig bestätigt. Die Fixierung auf steigende Schichthöhen, vielleicht in Analogie zu den erfolgreichen Ergebnissen der Submersfermentation, schreckte die damaligen Wissenschaftler jedoch nicht ab.
Und so entstand ein zylindrischer, aufrecht stehender SSF-Bioreaktor, bestehend aus drei konzentrischen, ringförmigen Kompartimenten mit perforierten Trennwänden. Im Zentrum befand sich ein perforiertes Lufteinleitungsrohr, nach außen umschlossen von dem Kompartiment zur Aufnahme des beimpften Substrats. Die Strömungsrichtung verlief horizontal durch das fermentierende Substrat in relativ geringer Schichtdicke (zirka 9 cm). Das Abgas verließ den SSF-Biorektor durch den peripheren, ringförmigen Raum. Die Höhe des mit Substrat gefüllten Bereiches betrug 90 cm.
Obwohl dieser SSF-Bioreaktor-Typ allgemein im Zusammenhang mit dem High-Heap-Prozess diskutiert wird, ist es offensichtlich, dass es sich hierbei eher um eine Modifikation des Tablett-Verfahrens mit erzwungener Durchströmung durch Druckerhöhung handelt.
Die Wissenschaftler hatten im Grunde die Aussichtslosigkeit ihrer früheren Versuche mit dem High-Heap-Prinzip erkannt und wandten sich mit dieser Variante wieder der SSF in dünner Schicht (shallow layer) zu. Die Kapazität des Bioreaktors betrug 24 kg inokuliertes Substrat. Das Gerät konnte durch abnehmbare Platten an Ober- und Unterseite leicht befüllt und entleert werden. Die Reinigung der ausgedehnten perforierten Oberflächen erwies sich jedoch als sehr arbeitsaufwändig. Hinzu kamen die erheblichen Temperaturgradienten (zirka 10 °C) der fermentierenden Packung zwischen Eingangs- und Ausgangsseite. Diese lagen gerade noch in dem tolerierbaren Bereich für Wachstum und Enzymbildung durch Aspergillus oryzae.
Unter dem Gesichtspunkt eines heutigen, optimierten Fermentationsverfahrens erscheinen derartige Gradienten jedoch unakzeptabel. So konnten schon damals die mit diesem SSF-Bioreaktor erhaltenen Ergebnisse nicht mit denen in flacher Schicht (Tablett-Methode) konkurrieren. In SSF-Bioreaktoren der Tablett-Methode werden unter Volllast Temperaturgradienten von 3–4 °C erreicht, die innerhalb der verschiedenen produktbezogenen Optima liegen. Underkofler jedenfalls schloss 1947 aus den mäßigen Ergebnissen seiner High-Heap-Versuche, es sei töricht, mit diesem Prinzip eine Maßstabsvergrößerung anstreben zu wollen.[15]
Geneigter High-Heap SSF-Bioreactor
Der geneigte High-Heap SSF-Bioreaktor war in einem Winkel von 45° aus der senkrechten Position geneigt, um, wie Underkofler et al.[1] argumentierten, das Befüllen und Entleeren zu erleichtern. Diese Reaktortypen waren wesentlich größer als der vorerwähnte, vertikal ausgerichtete Typ. Ein Scale-Up bis in den industriellen Maßstab misslang jedoch auch mit diesem Typ.
Säulen-SSF-Bioreaktor
Ein Säulen-SSF-Bioreaktor besteht aus einer Glas- oder Plastiksäule mit Anschlüssen für Be- und Entlüftung. Die Temperierung erfolgt über einen Doppelmantel mit erwärmtem Wasser, sofern sich die Säule nicht in einem temperierten Raum wie einem Brutschrank oder ähnlichen befindet. Mit solchen Bioreaktoren, Durchmesser 10 cm, Höhe 150 cm, Totalvolumen zirka 12 l, mit einer Substratkapazität von 8 kg (Feuchte 22 %, w/w), wurden Anfang der vierziger Jahre in den USA Versuche zur Massenproduktion von Aflatoxinen durch Fermentation von Weizen, Haferspelzen, Hafergrütze und Mais mit Aspergillus flavus oder Aspergillus parasiticus durchgeführt. Die Kontrolle der Feuchtigkeit erfolgte durch befeuchtete (80–85 % rel. Feuchte) Luft. Die Fermentation dauerte 10 Tage bei 33 °C. Die Aflatoxingehalte betrugen mehr als 1 g/kg fermentiertes Substrat.[16] Diese Ergebnisse stimmen mit denen von Hesseltine[17] insofern überein, als während des größten Teils der SSF akuter Sauerstoffmangel zugleich mit erheblichem CO2-Überschuss und stellenweiser Überhitzung in der fermentierenden Packung geherrscht haben muss. Im Gegensatz zu den Ergebnissen von Hesseltine, der in vehement geschüttelten Kolben ohne Belüftung arbeitete, wurde die maximale Produktion von Aflatoxinen in statischer Kultur erreicht. Dieses Beispiel zeigt stellvertretend die schlechte Vergleich- und Übertragbarkeit der mit verschiedenen SSF-Kulturmethoden erhaltenen Ergebnisse.
Eine Batterie, bestehend aus 24 kleinen Säulen-SSF-Bioreaktoren, wurde von Raimbault und Alazard[18] verwendet. Säulen-SSF-Bioreaktoren sind wegen ihrer unverhältnismäßig langen Diffusionsstrecken und den damit verbundenen Mängeln bei Belüftung, Befeuchtung und Ventilation nur für den Labormaßstab geeignet. Die Ergebnisse sind nicht übertragbar. Insbesondere bei Säulen-SSF-Bioreaktoren lässt sich trotz erheblicher Gradienten bei der Belüftung, Ventilation und Temperierung häufig ein nur geringer Druckabfall über der Säule beobachten. Dies ist auf die Ausbildung bevorzugter Strömungskanäle innerhalb der Packung zurückzuführen. In diesen Kanälen wird die rasch durchströmende Luft aufgeheizt und trocknet die den Strömungskanal umgebenden Bereiche aus. Auf diese Weise wird ein Zuwachsen des Kanals verhindert. Die unmittelbar benachbarten, mit Mycel zuwachsenden Bereiche werden hingegen inadäquat belüftet und ventiliert. Der größte Teil der in der Säule befindlichen Packung befindet sich also weit außerhalb optimaler Fermentationsbedingungen. Die Probleme mit den Säulen-SSF-Bioreaktoren sind in verschärfter Weise dieselben, wie für den High-Heap-Typ erörtert.
Plastiksäcke
Plastiksäcke mit 2,8 oder 40 kg Weizenstroh als Substrat wurden unter geeigneten Bedingungen fermentiert.[19] Etwa dasselbe Verfahren wurde sechs Jahre später von Hesseltine zur Herstellung von Tempeh, einem indonesischen Grundnahrungsmittel, auf Sojabohnen propagiert.[20] Tempeh lässt sich als vegetarisches Schnitzel mit antioxidativen Eigenschaften, positiven Effekten auf die Biosynthese von Hämoglobin, erhöhten Gehalte an Vitamin B2, Vitamin B6, Vitamin B12, Pantothensäure, Niacin und Tocopherol charakterisieren. Es wird in der amerikanischen Ernährung als Health Food klassifiziert. Entsprechend der Empfehlung Hesseltines zur Vereinfachung des SSF-Prozesses[20] werden die feuchten, sterilisierten und nach dem Abkühlen beimpften Sojabohnen in perforierte Plastiksäckchen gefüllt, flach gedrückt, eingeschweißt und bei 30–32 °C in normalen Brutschränken inkubiert. Im Inneren der Packung herrschen Temperaturen um 37 °C. Infolge des Sauerstoffmangels und der relativ hohen Feuchtigkeit innerhalb der Packung (Sättigung mit kondensiertem Oxidationswasser) verläuft das Wachstum von Rhizopus oligosporus oder anderen, nahe verwandten Arten mit einer Dauer von 48–72 h stark verzögert, verglichen mit einer Kultur in flachen Tabletts (relative Feuchte der Atmosphäre zirka 95 %, des fermentierenden Substrats 48–52 % {w/w}, Dauer 15–18 h). Durch den Sauerstoffmangel und die relativ hohe Feuchtigkeit des Substrats wird außerdem das Wachstum von fakultativ anaeroben Bakterien – neben den für die Produktion von Vitamin B12 erwünschten Klebsiella pneumoniae[21] oder Citrobacter freundii[22] unerwünschten Enterobakterien – begünstigt.
Bei geringsten Mängeln in der Betriebshygiene kommt es in dem nährstoffreichen Substrat wegen der kurzen Verdopplungszeiten (zirka 30 min) der unerwünschten Bakterien durch selektive Anreicherung zu schweren Kontaminationen (3*108 Keime/g Produkt) mit Coliformen, anderen fäkalen Keimen und Pseudomonaden, wie sich im Naturkostbereich und bei der Verabreichung von Health Food in Kliniken an Krebspatienten im Endstadium wegen seiner vermuteten anticarcinogenen Inhaltsstoffe zeigte.[23]
Diese Beispiele zeigen, dass selbst die verhältnismäßig einfach zu betreibenden SSF ein gewisses Maß an Ausbildung und Verantwortungsbewusstsein erfordern. Wie die voranstehenden Ausführungen zeigen, besteht bei der Plastiksackmethode wegen der prozessbedingten, selektiven Anreicherung unerwünschter, unter Umständen humanpathogener Mikroorganismen ein hohes Risiko. Derartige Risiken sind bei der Kultur in flachen Tabletts nicht zu befürchten.
Schlussfolgerungen
In den vorangehenden Abschnitten wurden stationäre SFB behandelt. Es wurde gezeigt, dass Schichthöhen des fermentierenden Substrats oberhalb von zirka 4 cm zu Limitierungen bei Sauerstoffversorgung, Ventilation von überschüssigem CO2, nicht tolerierbaren Temperaturgradienten, Austrocknen und, im ungünstigsten Fall, irreversibler Schädigung der Kultur führen. Zahlreiche Versuche, die Schichtdicke des fermentierenden Substrats, vielleicht analog zu den erfolgreichen Ergebnissen in der Submersfermentation (STF), auf bis über 1,50 m zu steigern, führten während der vergangenen fünf Jahrzehnte zu mäßigen Resultaten. Underkofler, einer der großen alten Pioniere der SSF in den USA, gelangte nach umfangreichen Untersuchungen zu dem Schluss, der Versuch einer industriellen SSF in hoher, statischer Schicht sei töricht.[24] Er erhoffte sich einen Ausweg aus dem Gradientendilemma hoher fermentierender Substratschichten durch deren regelmäßige Umwälzung.
Instationäre Anlagen
Ungeachtet zahlreicher Veröffentlichungen über ungünstige Ergebnisse bei Feststoff-Fermentationen (SSF) mit gerührten, geschüttelten oder rotierenden SSF-Bioreaktoren, insbesondere beim Versuch, Ergebnisse aus dem Labor- in den Pilot- oder Produktionsmaßstab zu übertragen, erscheinen bis in die letzten Jahre hinein vereinzelt Mitteilungen über erfolgreich verlaufene SSF mit bewegtem Substrat. Es ist daher Gegenstand dieses Abschnitts, die scheinbar widersprüchlichen Ergebnisse der letzten etwa sieben Jahrzehnte kritisch auszuwerten.
Eine Umwälzung des fermentierenden Substrats wird von verschiedenen Autoren erwähnt.[2] [3][4] Sie berichteten damit bei größeren Schichtdicken über eine gleichmäßigere Verteilung des Inokulums, gleichmäßigeres Wachstum als es sonst wegen der in höherer Schicht extremen Gradientenbildung erreichbar gewesen wäre. Aggregate wurden aufgebrochen, Gas- und Wärmeaustausch wurden verbessert. Die Geschwindigkeit der Umwälzung war dem Sauerstoffverbrauch proportional. Jedoch waren die berichteten Fermentationszeiten wesentlich länger und das Wachstum deutlich schwächer als mit stationären SFB in flacher Schicht.
Andere Autoren berichteten demgegenüber, der Effekt der Substratumwälzung sei keineswegs wachstumsfördernd. Underkofler et al.[24] erlebten beim Scale-Up ihrer Rotary Drum Bioreaktoren vom 20 L-Maßstab an aufwärts Schwierigkeiten mit unzureichendem Wachstum. Die Ursache war eine Zerstörung des empfindlichen Mycels durch die beim Umwälzen auftretenden Scherkräfte, je größer der Rotary Drum Bioreaktor, desto größer diese Schwierigkeiten. Extrahierte Zuckerrübenschnitzel, imprägniert mit Saccharose zur Umwandlung in Citrat durch Aspergillus niger, ergaben unbefriedigende Resultate, wenn die SSF in langsam gedrehten Rotary Drum Bioreaktoren stattfand.[5]
Im Gegensatz hierzu erzielte Takamine[2] relativ gute Ergebnisse mit seinen Rhizopus-Fermentationen in Rotating Drums. Takamine räumte eine Schädigung des Mycels auf der Oberfläche der Substratpartikel durch Scherkräfte ein und erklärte seine zufriedenstellenden Ergebnisse damit, dass das auf den konkav eingewölbten Bereichen der Substratpartikel wachsende Mycel vor Scherkräften geschützt sei. Der verheerende Effekt von Scherbelastungen auf das Wachstum von Mycel wurde durch weitere Arbeiten bestätigt.[6] [7]
Es sei an dieser Stelle erwähnt, dass die Feuchtigkeit des Substrats für SSF in rotierenden oder gerührten SFB auf wesentlich niedrigere Werte als für stationäre eingestellt werden muss, um während des Umwälzens ein Verklumpen des Substrats zu vermeiden.
Kunz & Stefan[8] verwendeten einen kleinen (1,4 kg Kapazität) SFB, dessen behutsam taumelnde, dreidimensionale Bewegung nach Angaben der Erfinder[9] in SSF mit Monascus purpureus ein Verklumpen des feuchten Substrats weitgehend vermeidet.[10] Nun sind SSF mit Monascus purpureus auf geschältem Reis insofern ein Sonderfall, als dieser Pilz nur bei vergleichsweise niedriger Substratfeuchtigkeit (25–28 %, w/w) akzeptable Pigmentausbeuten liefert. Kunz & Stefan hatten zirka 30–35 % (w/w) in ihrem „SWING“-SFB. Unter diesen Bedingungen klumpte in keinem der vom Verfasser erprobten instationären SFB (Rotary Drum-SFB mit oder ohne Schikanen, gerührten SFB mit flachen, abgerundeten oder helikalen Rührorganen, die SFB hatten 4–16 kg Substratkapazität) das äußerlich trocken erscheinende Substrat. Es blieb während der gesamten Fermentationsdauer rieselfähig. Die dem „SWING“-SFB assoziierte Besonderheit einer verklumpungsfreien Substratumwälzung müsste also erst noch in Kulturen mit zum Beispiel Rhizopus oder Aspergillus bestätigt werden, die, sollen die Fermentationszeiten nicht über jedes vertretbare Maß hinaus ansteigen, bei wesentlich höheren Substratfeuchtigkeiten (45–60 %, w/w) betrieben werden müssen. Mit einem größeren „SWING“-SFB (200 kg Substratvolumen) fehlen bis jetzt praktische SSF-Erfahrungen.
Es kann jedoch, ähnlich wie bei Underkofler, erwartet werden, dass mit durch den Druck der auflastenden Substratpackung zunehmender Intensität der Scherkräfte ähnliche Schwierigkeiten auftreten werden, wie sie für die Rotary Drum – SFB beschrieben wurden, die eine Maßstabsvergrößerung in den Produktionsmaßstab unmöglich gemacht haben.
Ein Vergleich stationärer SFB (Tablett-Methode)[17] mit den instationären Systemen zeigt, dass die Fermentationsdauer in den instationären SFB wesentlich länger ist. Abgesehen davon, dass die Investitionskosten für instationäre SFB (zirka DM 5000–3000/kg Substratkapazität) wesentlich höher sind als für stationäre (DM 2000–300/kg Substratkapazität – mit zunehmender Kapazität nimmt der Wert ab), ist die durch Umwälzung bedingte Verzögerung der SSF aus ökonomischer Sicht nur zu rechtfertigen, wenn die höheren Prozesskosten durch höhere Durchsatzleistung, höhere Ausbeute und Qualität aufgewogen werden.
Aus den Angaben in der Literatur sowie eigenen experimentellen Erfahrungen muss jedoch eher auf das Gegenteil geschlossen werden. Eine Ausnahme sei jedoch erwähnt: die industrielle Produktion von Enzymen durch SSF in Japan. Dort werden 100 t-Substrat-Ansätze etwa nach der Hälfte der Fermentationsdauer kurz umgewälzt. Die hierdurch bedingte Verzögerung (bei Industriestämmen von zirka 24 in shallow layer auf >140 Std.) scheint jedoch angesichts des breiten physiologischen Bereiches, in dem, ungeachtet der starken Gradientenbildung, eine akzeptable Enzymproduktion stattfindet, vertretbar zu sein.
Methoden der Substratumwälzung in SSF
Als bei Vergrößerung der Schichtdicke des fermentierenden Substrats Schwierigkeiten bei der Konstanthaltung von Temperatur, Feuchtigkeit, Belüftung sowie Abführung von CO2 auftraten, schien zur Beseitigung dieser Probleme, wie in der STF, die Substratumwälzung die Methode der Wahl zu sein. Die mit einer Substratumwälzung verbundenen Vorteile sollten sein:
- gleichmäßige Verteilung des Inokulum
- gleichmäßigeres Wachstum auf den Substratpartikeln
- Verhinderung der Bildung von Aggregaten
- verbesserte Ventilation der einzelnen Substratpartikel
- Erleichterung des Gasaustauschs
- Verbesserung der Wärmeabführung
- Vermeidung lokaler Gradientenbildung
- Gewährleistung homogener Bedingungen während der gesamten Fermentationsdauer
Entsprechend diesen Vorstellungen schien die Umwälzgeschwindigkeit (ähnlich wie in der STF) in direkter Korrelation mit dem Sauerstoffbedarf der Kultur zu stehen.[2] [3][4] Diese Autoren stellten fest, dass die Ergebnisse in den bewegten SFB schlechter waren als die in stationären SFB (Tablett-Methode).[17] Die unterschiedlichen Konzepte der Substratumwälzung während SSF werden im Folgenden erörtert.
Konstruktion
Die Konstruktion eines Rotating Drum SFB – dieser Typ ist hauptsächlich von historischem Interesse – entspricht der eines drehrunden Hohlzylinders, gelagert auf Rollen, über die zugleich der Antrieb des Hohlzylinders erfolgt. Alternativ hierzu wurde ein einem Uhrwerk (mit niedriger Übersetzung) nachempfundener Antrieb über eine zentrale Welle verwendet.[12] Die Umdrehungsgeschwindigkeit war gewöhnlich 1–5/min[12], in anderen Fällen jedoch 6–16/min.[12] [21] Die Behälter waren 19 L-Glasballons oder Eisenkessel[21], Mörtelkübel[12], Tonnen mit einer Kapazität von zirka 215 L[6], Betonmischer mit Kapazitäten von 70[25] und 114 L[26] sowie Druckkessel mit Kapazitäten von 0,1, 1, 5, 20, 70 kg bis in den Industriemaßstab.[21] Die Rotary Drum SFB waren mit Anschlüssen für Be- und Entlüftung versehen. Das Lufteinleitungsrohr reichte bis annähernd auf den Boden der Trommel.[27] In einer anderen Ausführungsform verzweigte es sich mehrmals zu Wirteln, wobei die Enden als Düsen ausgebildet waren.[12] Die Belüftung erfolgte durch Anlegen von Unterdruck[12] oder Pressluft. Zur Sterilisation wurde die Frischluft durch Schwefelsäure und anschließend zur Befeuchtung durch steriles destilliertes Wasser geleitet.[27] Die Vorbereitung des Substrats (Einweichen, Dämpfen, Beimpfen, Bebrüten und Trocknen) fanden in situ statt.[12]
Rotary Drum SFB mit Schikanen erwiesen sich ihren unbewehrten Pendants gegenüber als überlegen.[28] [27] Für Serienversuche wurde der Innenraum der Trommel axial in drei bis vier separate Kompartimente, jedes mit Schikanen versehen, unterteilt.[28] In den kleinen Rotary Drum SFB war das Wachstum rasch und gleichmäßig.[12] [21] Schwierigkeiten traten beim Scale-Up auf, da das empfindliche Mycel während des frühen Wachstums durch die Scherkräfte der aneinander entlangrutschenden Partikel zerrieben wurde.[12] Dieses Problem nahm mit der Größe der Rotary Drum SFB zu.[27] Darüber hinaus erwiesen sich andere Faktoren wie:
- Temperaturkontrolle
- Mikrobielle Kontamination
- Verklumpen des Substrates
- Wachstumshemmung infolge von mechanischer Zermürbung des Mycels
als mit Rotary Drum SFB nicht lösbar.
Labormaßstab
Rotary Drum SFB ergaben zufriedenstellende Ergebnisse (es wurde von den Autoren mehrfach betont, dass diese nicht mit denen in stationären SFB {Tablett-Methode[1]} mithalten konnten), solange die Beladung in einem 20 l-Kessel 1–2 kg nicht überschritt. Die vernünftig nutzbare Substratkapazität lag also bei unter 10 % (w/v). Luft wurde langsam eingeleitet. Das fermentierende Substrat wurde möglichst in einem Bereich um 30 °C temperiert. Unter diesen Bedingungen erreichte die Temperatur im Innern des fermentierenden Substrats zirka 37 °C. Erreichte die Außentemperatur 35 °C, stieg die Temperatur innerhalb des Substrats bis auf über 42 °C, was zu einer irreversiblen Schädigung der Kultur führte.
Während der Keimung des Inokulums, das heißt 12–15 Stunden nach dem Beimpfen, wurde die Trommel periodisch umgewälzt (alle zwei Std. für jeweils 15–20 min). Nach dem Auskeimen wurde die Trommel permanent über 40–45 Stunden gedreht (1/min). Vor Beginn der Sporulation wurde das Substrat entnommen, getrocknet, vermahlen und als Enzymgemisch zur Hydrolyse von Maisstärke eingesetzt.
Vergleichende Untersuchungen zur Herstellung von Koji (Pilzenzymgemischen) für die Produktion von Sojasauce (Shoyu) mit Rotary Drum SFB und der stationären Tablett-Methode verliefen zu Ungunsten der Rotary Drum SFB. Obwohl (infolge des Mangels an Amylasen, Proteasen etc.) die analytischen und sensorischen Werte des mit „Rotary Drum Koji“ erzeugten Shoyus nicht an das mit der Tablett-Methode erzeugte heranreichten, beurteilten die Autoren das für sie enttäuschende Ergebnis diplomatisch als „zufriedenstellend“. Der durch Rollen umgewälzte SFB (4/min) war ein 20 l-Glasgefäß, 20° geneigt. Die maximal sinnvolle Nutzlast betrug 1,8 kg eines Gemischs aus Sojabohnen und Weizenmehl (Feuchtigkeit 43–49 %, w/w). Dies entsprach einer Substratskapazitätsrate von nur 9 % (w/v). Das Inokulum (Aspergillus oryzae) betrug 1010 Sporen/1,8 kg (zirka 1 %, w/w). Die Fermentationstemperatur lag bei 30 °C. Befeuchtete Luft (0,05 vvm) wurde eingeblasen. Bereits bei dieser geringen Ansatzgröße gelang es während des stärksten Wachstums (40 Std. nach Inokulierung) nicht, die Temperatur in dem fermentierenden Substrat unter 39–42 °C zu halten. Dieses Problem verschärfte sich bei einer größeren Beladung mit Substrat. Die Fermentationsdauer betrug 72–74 Std. (verglichen mit 24–28 Std. in modernen SFB mit der stationären Tablett-Methode).
Die Versuche zum Scale-Up der Rotary Drum SFB scheiterten. Die Ursache war, dass das Mycel durch die Scherkräfte massiv geschädigt wurde. Als Ausweg aus diesem Dilemma wandte sich Underkofler[16] erneut der stationären SSF in hoher Schicht zu. Ein weiterer Nachteil der SSF in Rotary Drum SFB war der geringe Enzymgehalt. Auch dieser Nachteil wurde von verschiedenen Autoren auf die Zerstörung des wachsenden Mycels durch Scherkräfte zurückgeführt [18, 19]. Nach Auffassung anderer Autoren überwog jedoch der Vorteil der größeren Substratkapazitätsrate (kg Substrat/L Volumen, w/v), verglichen mit dem damaligen Stand der stationären Tablett-Methode.[20]
Gerührte SFB
Insbesondere im Laboratoriums- und Pilot-Maßstab ist das Bestreben groß, eine Vielzahl von Messgrößen möglichst kontinuierlich mit Sonden zu erfassen, um einen Fermentationsprozess besser verstehen und steuern zu können. Anschluss und Verkabelung von Sonden etc. bereiten bei Rotary Drum SFB erhebliche Schwierigkeiten, wenn man die Installation nicht im Bereich der Rotationsachse vornehmen kann. Instatische SFB, die diesen Nachteil nicht besitzen, sind solche mit installierten Rührorganen oder SFB, die Taumelbewegungen durchführen. In Anbetracht eines gegebenenfalls erforderlichen Scale-Up in den Produktionsmaßstab (>> 1 t/Ansatz) kommt ein SFB, der Taumelbewegungen ausführt, weniger in Betracht.
SFB mit installierten Rührwerken (Substratkapazität 4 bzw. 20 kg) besaßen zu Beginn der achtziger Jahre Anschlüsse für sämtliche in Betracht kommenden Operationen. Das Substrat wurde durch sich selbst abstreifende Rührorgane mit variabler Umdrehungsgeschwindigkeit (0,5–30/min sowie umkehrbare Drehrichtung) kontinuierlich oder programmierbar diskontinuierlich umgewälzt. Sämtliche Prozessschritte (Einweichen, Drainieren des überschüssigen Einweichwassers, Sterilisieren bis 138 °C mit gespanntem Dampf, Beimpfen, Temperieren, Belüftung, Befeuchtung, Probenentnahme, ggfs. Trocknung des fermentierten Produkts etc.) konnten in situ durchgeführt werden. Die Substratkapazitätsrate war 32 % (w/v) bzw. zirka 80 % (Volumenanteil). Dieser SFB-Typus lieferte Ergebnisse, die denen mit der Tablett-Methode erhaltenen nahekamen. Jedoch dauerten die SSF signifikant länger als in den stationären SFB. Die Ursachen hierfür lagen in der:
- wegen der höheren Schichtdicke gelegentlich erforderlichen Umwälzung des Substrats zur Aufbrechung von Aggregaten, in der Regel für einige Minuten während der Halbzeit
- geringeren Feuchtigkeit (25–35 %, w/w), auf die das Substrat eingestellt werden musste, um ein Verklumpen des fermentierenden Substrats während des Umwälzens zu vermeiden
Ein Nachteil dieses SFB-Typs waren jedoch die verhältnismäßig hohen Kosten, etwa DM 4000/kg für einen Labor- bzw. kalkulierte DM 1500–2000/kg für einen kleinen Produktions-SFB. Da dieses Konzept, insbesondere im Produktionsmaßstab, mehrfach teurer war als ein stationärer SFB nach der Tablett-Methode[17], wurde es gestoppt. Dessen ungeachtet befinden sich diese SFB auch nach mehr als 25 Jahren im industriellen F&E-Einsatz.
„Taumel“-SFB
Ein anderer instationärer SFB-Typ mit dreidimensionaler Taumelbewegung (system with internal gyration = SWING), der, wie die Erfinder betonen, die für den Rotary Drum-SFB genannten Nachteile nicht besitzt, besteht aus einem durchsichtigen Plastik-Hohlzylinder mit Anschlüssen für Be- und Entlüftung sowie für externe Temperaturkontrolle. Ursprünglich war das Gerät als Mischer konzipiert und entwickelt worden[9], eignete sich erwartungsgemäß aber gleichermaßen für die Durchmischung von rieselfähigem, fermentierendem Substrat. Das sterilisierte und inokulierte Substrat wird in das Gefäß eingebracht. Die maximale Kapazitätsrate dieses Labor-SFB (2 L Totalvolumen) liegt bei 28 % (w/v). Dies entspricht einer Füllung von zirka 70 % (Volumenanteil). Das Gerät ist begreiflicherweise nicht in-situ-sterilisierbar. Die Sterilisation des Behälters wird durch Benetzen mit 70 % Ethanol erreicht (Kunz {1997}, pers. Mitt.).
Die Erfinder des SWING-Mischers[9] betonen als herausragende Eigenschaft dieses Mischers das klumpenfreie Vermischen des mit Monascus purpureus beimpften Reis (zirka 30 % Feuchtigkeit, w/w) während der SSF im 1- bis 1,4 kg-Maßstab. Die Bewährungsprobe des SWING-Konzepts in SSF, insbesondere bei Substratfeuchtigkeiten von erheblich über 30 % (w/w), steht also aus. Obwohl angeblich ein 200 L-Mischer verfügbar ist, fehlen entsprechende Untersuchungen mit SSF-Prozessen. Die hohen Investitionskosten, zirka DM 5000/kg Substrat (Doman (1997), pers. Mitt.) erscheinen, analog zu dem im vorangehenden Kapitel behandelten gerührten SFB, als gravierender Nachteil, der wohl einem ökonomischen Betrieb im Produktionsmaßstab im Wege stehen wird.
Rotary Drum-SFB im Industriemaßstab
Große Rotary Drum-SFB sind in japanischen Unternehmen seit Ende der fünfziger Jahre für die Produktion von Miso in Betrieb.[21] Dies kann als Anhaltspunkt dafür gewertet werden, dass die in den vorangehenden Kapiteln erwähnten Schwierigkeiten in japanischen Unternehmen nicht bzw. in weniger gravierendem Umfang existieren. Die Misoproduktion erfolgt halbkontinuierlich und ist weitgehend automatisiert. Rotary Drum-SFB's werden vor allem für die Produktion von Reis- und Gersten-Koji (Substrat-Enzymgemisch nach SSF) eingesetzt. Gekochter und beimpfter Reis wird in die große Trommel gefüllt, in dem temperierte und befeuchtete Luft zirkuliert. Die Trommel wird gelegentlich umgewälzt, um ein Agglomerieren des fermentierenden Substrats zu vermeiden. Die Rotary Drums haben Durchmesser von zirka 3 m mit geschätzten Kapazitäten zwischen 10 und 20 t, vielleicht mehr. Sie befinden sich batterieweise in großen Räumen. Zweifellos spielt bei diesen Prozessen die sorgfältige Einstellung der Substratfeuchtigkeit auf verhältnismäßig niedrige Werte zur Vermeidung des Aneinanderklebens der Substratpartikeln eine entscheidende Rolle.
Kriterien der Auslegung
Verschiedene Konzepte zur Auslegung und Gestaltung von Feststoff-Bioreaktoren sind bekannt. Zu den am häufigsten in der Fachliteratur diskutierten Typen zählt der sogenannte „Rotary Drum Reaktor“. Dieser besteht aus einem auf der Seite liegenden, hohlen Zylinder, in dessen Innenraum Mikroorganismen auf festen Substraten kultiviert werden sollen. Da das Substrat sich in diesem Bioreaktortyp in einer relativ dicken Schicht befindet, muss es zur Aufrechterhaltung einer ausreichenden Ventilation (Abführen der Oxidationswärme, Entfernung von überschüssigem Kohlendioxid, ausreichende Versorgung mit Sauerstoff sowie Feuchtigkeit) während der Fermentation ständig oder in regelmäßigen Intervallen umgewälzt werden. Ein wesentlicher, hiermit verbundener Nachteil ist jedoch, dass das an der Oberfläche des partikulären Substrates befindliche Pilzmycel durch die bei der Umwälzung auftretenden Scherkräfte geschädigt wird. Hierdurch wird die Stoffwechselaktivität der betreffenden Kultur stark vermindert, oder sie kommt sogar zum Stillstand, bevor sie sich nach mehreren Stunden ohne Umwälzung allmählich wieder erholen kann. Die Rotary Drum Reaktoren sind wegen dieses Nachteils vom Markt verschwunden.
Es wurde daher versucht, ruhende, statische Kulturen großer Schichtdicke (bis 1,50 m) zu kultivieren. Hiermit ist jedoch der Nachteil verbunden, dass wegen der hohen Schichtdicke erhebliche Diffusionswiderstände auftreten. Diese lassen sich nur durch das Einblasen von Luft oder anderen, geeigneten Gasgemischen unter Druck überwinden. Außerdem vergrößert sich bei fortschreitendem Mycelwachstum der Diffusionswiderstand infolge des Zuwachsens der interpartikulären Räume derart, dass vor Erreichen des maximal möglichen Wachstums der Prozess wegen Überhitzung, Mangel an Kohlendioxidventilation sowie Mangel an Sauerstoffversorgung zusammenbricht und daher vorzeitig abgebrochen werden muss. Bei einer weiteren Variante wird die SSF in einer relativ dünnen Schicht, auf flachen Tabletts, durchgeführt. Hierdurch werden die für die anderen beiden Typen beschriebenen Nachteile vermieden, jedoch tritt ein anderer Nachteil auf; denn wegen des auf viele flache Tabletts verteilten, in Abständen installierten Substrates sinkt die auf das Gesamtvolumen des Bioreaktors bezogene Nutzlast erheblich. Ein weiterer Nachteil der bisher für die Kultur in flachen Tabletts verwendeten Bioreaktoren ist, dass die Oxidationswärme durch eine entsprechende Intensität der Durchströmung des Reaktorraumes mit angefeuchteter, steriler Luft kompensiert wird. Mit zunehmendem Wachstum führt dies bei, wie in der Praxis üblich nur geringfügig geringeren Temperatur der Zuluft, im Reaktionsraum zu notwendigen Luftwechselraten von bis mehr als 100 Luftwechseln/h. Hierdurch werden jedoch Überströmungsgeschwindigkeiten erzeugt, bei denen das an der Oberfläche befindliche Mycel mit signifikant verringerter Stoffwechselaktivität phänotypisch nach Art von Wetterfichten wächst. Dies ist jedoch im Interesse einer optimalen Prozessführung unerwünscht. Ein weiterer Nachteil der für die Kultur in flachen Tabletts bisher verwendeten Bioreaktoren ist, dass, insbesondere bei größeren Anlagen unter Volllast und intensivem Wachstum, erhebliche Mengen an geruchsintensiver und keimbelasteter Abluft entsorgt werden müssen. Ein weiterer Nachteil der für die Kultur in flachen Tabletts verwendeten Bioreaktoren ist, dass der Dampf für die Befeuchtung der eingeblasenen Luft bzw. des Gasgemisches in thermischen Dampferzeugern bereitgestellt wird. Hierdurch sind erhebliche Anstrengungen zum Herunterkühlen des heißen Dampfes auf Fermentationstemperaturen (25–35 °C) bedingt. Beim Herunterkühlen geht jedoch ein großer Teil des Wasserdampfes durch Kondensation wieder verloren. Dies bedingt einen relativ geringen Wirkungsgrad und eine hieraus resultierende überdimensionale Anlage zur Luftbefeuchtung. Wegen dieser Nachteile wird daher, wie bereits erwähnt, in der Regel die einzublasende, befeuchtete Luft auf eine Temperatur abgekühlt, die nur unwesentlich unterhalb der gewünschten Reaktorinnentemperatur liegt. Dies bedingt einen relativ geringen Wirkungsgrad bei der notwendigen Ableitung von Oxidationswärme.
Ein SSF-Bioreaktor, der die voranstehend aufgeführten Nachteile vermeidet[28] [29], wird im Folgenden beschrieben. Er ist dadurch gekennzeichnet, dass:
- im Innenraum in einem Winkel von 10–15° geneigte Tabletts angeordnet sind
- die Versorgung der Kultur mit einer definierten Gasatmosphäre durch eine strömungs- bzw. druckgeregelte Begasungseinrichtung erfolgt
- die Befeuchtung des temperierten Gasvolumenstromes auf eine relative Feuchte zwischen 40 und 99 % durch eine Vorrichtung zur Erzeugung von kaltem Wassernebel erfolgt
- im Inneren eine Vorrichtung zur Luftumwälzung angeordnet ist, und die Luft bzw. das Gasgemisch in einer durch Leitbleche zwangsweise geführten Strömung und mit geringer Strömungsgeschwindigkeit von der tiefer gelegenen Seite des Tabletts an der Ober- und Unterseite desselben entlang zu dessen höher gelegener Seite streicht
- zur Abführung der Oxidationswärme an den Leitblechen Wärmeaustauscher vorgesehen sind, deren Temperatur 2–3 °C unterhalb der gewünschten Fermentationstemperatur liegt
- zur Sterilisation des SFB eine drucklose Heißdampfversorgung oder die Temperierung auf 180 °C vorgesehen ist
- zur Ableitung von Kondensat am tiefsten Punkt des Reaktor-Innenraumes ein Ablauf mit einer hitzesterilisierbaren Falle installiert ist
- zur Ableitung der Abluft oberhalb des SFB eine hitzesterilisierbare Vorrichtung zum Ableiten, Sterilisieren und, gegebenenfalls, Desodorieren der geruch- und keimbelasteten Abluft vorhanden ist
Die durch die vorgenannten Kriterien erzielten Vorteile für den Verfahrensablauf werden im Folgenden erläutert:
So sind Gasaustausch und Wachstum einer Kultur von Aspergillus niger bei einer Neigung der Tabletts von 15° gegenüber anderen auf dem Markt befindlichen Systemen wesentlich beschleunigt: Das Wachstum ist nach zirka 24 h optimal, verglichen mit 48 bis 72 h in anderen SSF-Bioreaktoren. Dies verbessert die Durchsatzleistung um über 100 %. Infolge der verbesserten Ventilation lassen sich die lichten Abstände zwischen den übereinander liegenden Tabletts auf 1 bis 4 cm gegenüber sonst 5 bis 15 cm verringern, und die Nutzlast-Kapazität wird um 35 % gesteigert.
In Kulturen mit Rhizopus oligosporus beträgt die Zeitspanne bis zum Erreichen des maximalen Wachstums 15–18 h gegenüber 48–72 h bei Systemen mit weniger effizienter Ventilation, die zur Verbesserung derselben auch noch Abständen durchmischt werden müssen. Die Durchsatzleistung wird hierdurch um über 100 % verbessert.
Infolge der regelbaren Umwälzung der Gasatmosphäre zur Vermeidung turbulenter Strömungen über dem bewachsenen Substrat lassen sich die Geschwindigkeit des Wachstums, die Produktbildungsrate sekundärer Metaboliten sowie die Ausbeute an Biomasse bzw. Produkt in Kulturen mit Penicillium chrysogenum um zirka 25 % steigern.
Die Gestaltung des Innenraums mit plattenförmigen, flachen Wärmetauschern sowie Leitblechen zur Erzeugung einer gerichteten Zwangsströmung führt in Kulturen mit Rhizopus oligosporus zu einer Verringerung der für eine ausreichende Ventilation erforderlichen Umwälzleistung sowie der erforderlichen Frischluftversorgung um jeweils zirka 50 %, verglichen mit anderen Systemen.
Die dosierte Zuspeisung von befeuchteter Frischluft zur Kompensation des durch eine Kultur von Aspergillus oryzae verbrauchten Sauerstoffs sowie zur Ventilation des produzierten CO2 ergibt, verglichen mit der sonst üblichen Frischluftversorgung, eine Verringerung des geruchsintensiven und keimbelasteten Abluftvolumens um zirka 80 %. Hierdurch wird eine signifikante Kostensenkung bei der Entsorgung der Abluft sowie eine entsprechende Senkung der Emissionen erreicht.
Die dosierte Zuspeisung von befeuchtetem Sauerstoff zur Optimierung der Sauerstoffversorgung für die Produktion sekundärer Metaboliten in einer Kultur von Penicillium chrysogenum führt bei einer Sättigung des Sauerstoffbedarfs der Kultur von zirka 80 % zu einer Ausbeutesteigerung von 45 % verglichen mit einer reinen Variation des Frischluftdurchsatzes. Das Wachstum sowie der Substratausbeutekoeffizient von verschiedenen Schimmelpilzen wird in einer definierten Gasatmosphäre bestehend aus N2, O2 und CO2 durch Partialdrücke von CO2 zwischen 3 und 5 % um zirka 25 % gegenüber entsprechenden, optimal belüfteten Kulturen gefördert.
Die Einspeisung von kaltem Wassernebel, ergibt, verglichen mit der sonst üblichen Einspeisung von heruntergekühltem Heißdampf, eine Energieeinsparung von 70 %. Infolge des im voranstehenden Beispiel beschriebenen, verringerten Wärmeeintrages lässt sich die Nutzlast mit einer Kultur von Aspergillus oryzae um den Faktor 2,5, d. h. um 250 %, im Vergleich zu anderen SSF-Bioreaktoren steigern.
Die Ausbildung ausgedehnter, flacher, plattenförmiger Wärmeaustauscherflächen anstelle einfacher Leitbleche zur Erzeugung eines gerichteten Luftstromes ermöglicht beim Überschreiten der Maximaltemperatur innerhalb enger Temperaturgrenzen von +1 °C eine leistungsfähige Kühlung, bei der die Temperatur der Wärmeaustauscherflächen nur zirka 2 °C unterhalb der erwünschten Fermentationstemperatur liegt. Hierdurch wird ein unerwünschtes Austrocknen der Gasatmosphäre weitgehend vermieden. Wie Vergleiche von Kulturen mit Aspergillus, Penicillium, Rhizopus, Mucor, Sporotrichum, Thermoascus, Monascus etc. mit solchen in herkömmlichen SSF-Bioreaktoren ergaben, werden bei maximaler Auslastung (240 kg fermentierendes Substrat) Wachstum bzw. Produktbildung infolge der verbesserten Konstanthaltung von Temperatur und Feuchtigkeit innerhalb des engen, optimalen Bereiches (+1 °C bzw. +1 % relative Feuchte) um 20 bis 30 % gesteigert. Infolge der im Vergleich zu thermischen Bedampfungssystemen in anderen SSF-Bioreaktoren effizienteren Befeuchtung der Atmosphäre lassen sich die Befeuchtungskapazität um zirka 60 % sowie die betreffenden Installationskosten um etwa denselben Prozentsatz reduzieren.
Infolge der Einhaltung der relativen Feuchte, einer in diesem speziellen Fall sehr kritischen Größe, innerhalb relativ enger Grenzen (95 +1 %) wird die Fermentationsdauer von Monascus purpureus zur Erzeugung des purpurroten Pigmentes auf sechs Tage verkürzt, verglichen mit 9 bis 21 Tagen in anderen Systemen.
Kulturen mit Sporotrichum thermophile sowie Thermoascus aurantiacus bei 51 °C in SSF zur Erzeugung von Cellulasen ergeben eine deutlich höhere Produktivität pro Volumen Medium bei höherer Temperaturstabilität der Enzyme als in STF mit denselben Stämmen. Die Fermentationsdauer in SSF bis zur Sporulation beträgt bei Sporotrichum thermophile 24, bei Thermoascus aurantiacus 28–30 h.
Untersuchungen zur Simulation der mikrobiell bedingten und volkswirtschaftlich nicht unbedeutenden Selbsterhitzung des Heus wurden bis zu einer Temperatur von 95 °C durchgeführt. Bei diesen Versuchen wurde die Temperatur des Bioreaktors derjenigen im lose gepackten Heu nachgeführt, um die Wärmeverluste der Heupackung an die Umgebung zu minimieren. Feuchtigkeit und Luftzufuhr wurden kontrolliert. Auf diese Weise wurden das Maximum des Wachstums thermophiler Mikroorganismen (Bacillus stearothermophilus sowie Thermoactinomyces vulgaris) und der Beginn der sogenannten pyrogenen Phase (ab zirka 95 °C) bereits nach 2–3 Tagen erreicht. Hieraus ergibt sich, dass der beschriebene SSF-Bioreaktor eine den Verhältnissen in Scheunen (2–3 Tage) stärker angenäherte Simulation der mikrobiellen Vorgänge bei der Selbsterhitzung des Heus erlaubt als die bisher speziell hierfür ausgelegten Vorrichtungen (7 bis 13 Tage, Fehlen definierter Feuchtigkeit und definierter Versorgung mit Luft bzw. Sauerstoff). Derartige Untersuchungen sind mit anderen SSF-Bioreaktoren aufgrund von deren eingeschränkten Arbeitsbereichen nicht möglich.
Der Ligninabbau von vermahlenem, pelletierten und mit den üblichen mineralischen Nährstoffen beaufschlagtem Holzmehl durch Phanaerochaete chrysosporium beträgt nach 6–7 Tagen 70 %, verglichen mit Zeiträumen zwischen 30 und 60 Tagen in anderen SSF bis zum Erreichen eines vergleichbaren Abbaugrades. Es sei darauf hingewiesen, dass in diesem Fall auch die Vorbereitung des Substrates einen wesentlichen Einfluss auf die Verkürzung der Fermentationsdauer hat.
Zukünftige Aspekte
Underkofler kehrte am Ende seiner Versuche mit den Rotary Drum – SFB unverrichteter Dinge zu den SSF in dünner Schicht zurück: Die SFB mit bewegtem Substrat konnten hinsichtlich der Produktqualität nicht mit den stationären SSF (Tablett-Methode) mithalten. Die westlichen Erfahrungen mit instationären SFB im universitären Bereich blieben bis heute auf den Labormaßstab (20 kg Substrat) beschränkt. In einigen westlichen Unternehmen laufen jedoch Anlagen mit 10- bis 100-facher Kapazität.
In Japan hingegen befinden sich industrielle Anlagen mit Kapazitäten von 10 bis 100 t beimpftes Substrat/Ansatz seit Jahrzehnten für die Produktion von Enzymgemischen in Betrieb. Diese Anlagen besitzen Vorrichtungen zur kurzzeitigen Umwälzung des fermentierenden Substrats nach etwa der Hälfte der Fermentationsdauer. Einweichen, Drainieren, Sterilisieren und Inokulieren des Substrats werden außerhalb der SFB vorgenommen. Die Prozesse verlaufen unter halbsterilen Bedingungen. Die für Koji angegebenen Fermentationszeiten mit zirka 50 Std. liegen signifikant über denen in stationären SFB (Tablett-Methode, 24–28 Std.), die Enzymausbeuten signifikant darunter. Da die Produktion von Enzymen durch Aspergillus oryzae innerhalb eines breiten physiologischen Bereichs (Temperatur 20 bis 41 °C, Feuchtigkeit 25 bis 60 %, w/w), Belüftung erfolgt, sind die in den großen Rotary Drums auftretenden Gradienten im Sinne einer noch zufriedenstellenden Enzymproduktion tolerierbar. Derartige SFB erscheinen wegen der erheblichen Gradienten jedoch für die großtechnische Produktion von sekundären Metaboliten, deren Produktionsoptima wesentlich schmaler sind, wenig geeignet zu sein. Soll daher die SSF zur Suche nach bisher unbekannten oder in niedriger Ausbeute darstellbaren Metaboliten eingesetzt werden, scheinen SFB, die nach der Tablett-Methode ausgelegt sind, am ehesten geeignet zu sein.
Für die Zukunft reizvolle Forschungsprogramme sowie erfolgversprechende Anwendungen der SSF könnten sein:[17] [6][22]
Forschung und Entwicklung
- Entwicklung mathematischer Modelle zur zuverlässigen Vorhersage und Optimierung von SSF-Prozessen
- Untersuchungen zum Stofftransfer, zur Wachstumsdynamik sowie zur Aufnahme gequollener Substrate durch Schimmelpilze
- Eingehendere Untersuchung der für SSF wesentlichen Faktoren
- gentechnologische Optimierung industriell wertvoller Stämme
- Erforschung der Einsatzmöglichkeiten von Hefen und Bakterien
- Erprobung im Hinblick auf bisher ungenutzte Bereiche der industriellen Mikrobiologie
- Erprobung von Mischkulturen außer für die Enzymproduktion
- Entwicklung einer raschen, einfachen und zuverlässigen Methode zur Bestimmung der mikrobiellen Biomasse in SSF
- Physiologische Differenzierung von Luft- und in das Substrat penetrierendem Mycel im Hinblick auf deren unterschiedliche Fähigkeit zur Produktion sekundärer Metaboliten
- Ermittlung der Faktoren für die metabolische Gleichschaltung von Luft- und penetrierendem Mycel
Kommerzielle Aspekte
- Entwicklung kostengünstiger automatisierter Anlagen für die Vorbehandlung des Substrats
- Produktion einzelner Enzyme statt, wie bisher überwiegend, komplexer Enzymgemische
- Modifizierung von Nahrungsmitteln (Aussehen, Textur, Geschmack, Nährwert) durch SSF bzw. mikrobielle Enzyme
- Verbesserung von für die Herstellung von Nahrungsmitteln eingesetzten Mikroorganismen
- Produktion von sekundären Metaboliten, Mycotoxinen, neuartigen Antibiotika, sonstigen Wirkstoffen
- Produktion von Pilzsporen
- Transformation organischer Verbindungen
- Produktion von Aromen, Riechstoffen
- Produktion von mikrobiellen Wirkstoffen gegen Pflanzenpathogene
- Proteinanreicherung kohlenhydratreicher landwirtschaftlicher Rohstoffe / Abfälle zur Verwendung als Futtermittel
- Entfernung persistenter Verbindungen aus dem Boden
Einzelnachweise
- Hesseltine, C.W. (1977). Process Biochem. 12 Nr. 6, 24–27.
- J. Takamine. Ind. Eng. Chem. 6, 1914, 824–828.
- Lindenfelser, L.A., Ciegler, A. (1975). Appl. Microbiol. 29, 323–327.
- Knapp, J.S., Howell, J.A. (1980). In: Topics in Enzyme and Fermentation Biotechnology, A. Wiseman, ed., vol. 4, S. 85–143, Ellis Horwood Ltd., Chichester.
- Cahn, F.J. (1935). Ind. Eng. Chem. 27, 201–204.
- Aidoo, K.E., Hendry, R., Wood, B.J.B. (1982). Adv. Appl. Microbiol. 28, 201–237.
- Vollbrecht, D. (1988). Forum Mikrobiol. 9, 386–394.
- Kunz, B., Stefan, G. (1992). Bioforum 15 Nr. 5, 160–163.
- Doman, M., Haukohl, M. (1991). Chem.-Techn. 20 Nr. 10, 1–2.
- Doman, M. (1997). pers. Mitt.
- Underkofler, L.A., Fulmer, E.I., Schoene, L. (1939). Ind. Eng. Chem. 31, 734–738.
- K.L. Schulze, Appl. Microbiol. 10, 1962, 108–122.
- Hesseltine, C.W., Shotwell, O.L., Ellis, J.J., Stubblefield, R.D. (1966). Bacteriol. Rev. 30, 795–805
- Han Y.W., Anderson, A.W. (1975). Appl. Microbiol. 30, 930–934.
- L.A. Underkofler, R. R. Barton und S. S. Rennert: Production of Microbial Enzymes and Their Applications; In: Appl Microbiol. 1958 May; 6(3): 212–221, PMC 1057391 (freier Volltext)
- Underkofler, L.A., Severson, G.M., Goering, K.J., Christensen, L.M. (1947). Cer. Chem. 24, 1–22
- Vollbrecht, D. (1997). Chem. Ing. Techn. 69, 1403–1408.
- Terui, G., Shibasaki, I., Mochizuki, T. (1958). Technology Report, Osaka Univ. 8, 213–219.
- Arima, K. (1964). In: Global Impact of Applied Microbiology, M.P. Starr, ed., S. 277–293, John Wiley & Son, New York.
- Aidoo, K.E., Hendry, R., Wood, B.J.B. (1984). J. Food Technol. 19, 389–398
- Fukushima, D. (1979). J Am Oil Chem Soc. 56, 357–362
- Lonsane, B. K., Ghildyal, N. P., Budiatman, S., Ramakrishna, S.V. (1985). Enzyme Microb. Tech-nol., 7 Nr. 6, 258–265.
- D. Vollbrecht: Adv. Food Sci. 19 Nr. 3/4, 1997, 87–89.
- Underkofler, L.A., Severson, G.M., Goering, K.J., Christensen, L.M. (1947). Cereal Chem. 24, 1–22.
- Terui, G., Shibasaki, I., Mochizuki, T. (1957). Hakko Kogaku Zasshi 35, 105–116.
- Lakshminarayana, K., Chaudhary, K., Ethiraj, S., Tauro, P. (1975). Biotechnol. Bioeng. 17, 291–293.
- Silman, R.W., Conway, H.F., Anderson, R.A., Bagley, E.B. (1979). Biotechnol. Bioeng. 21, 1799–1808.
- Hao, L.C., Fulmer, E.I., Underkofler, L.A. (1943). Ind. Eng. Chem. 35, 814–818.
- Vollbrecht, D. (1994). DE 44 06 632.
Literatur
- Handbook of applied mycology, von Dilip K. Arora, Libero Ajello, K. G. Mukerji (als Google-Book)
- Handbuch der Biotechnologie, von Paul Präve, Uwe Faust, Wolfgang Sittig (als Google-Book)