Fluoreszenzlebensdauer
Die Fluoreszenzlebensdauer , früher auch Fluoreszenzabklingzeit, gibt die mittlere Zeit an, die ein Molekül bei der Fluoreszenz in einem angeregten Zustand bleibt, bevor es ein Photon emittiert und damit in den Grundzustand zurückkehrt.
Typische Fluoreszenzlebensdauern liegen in der Größenordnung von 10−9 bis 10−7 s. Dabei ist zu beachten, dass es sich bei der Fluoreszenz um einen spinerlaubten Vorgang handelt. Bei der spinverbotenen Phosphoreszenz dagegen ergeben sich um Größenordnungen längere Lebenszeiten im Bereich von Millisekunden bis Stunden.
Bedeutung
Die Fluoreszenzlebensdauer ist in der Spektroskopie und Mikroskopie (Fluoreszenzlebensdauer-Mikroskopie) ein wichtiger Messparameter, der zur Unterscheidung verschiedener (auch gleichfarbiger) Fluorophore dient. Darüber liefert die Fluoreszenzlebensdauer wichtige Informationen über die chemische Umgebung eines Fluorophors und kann Energietransfermechanismen, wie den Förster-Resonanzenergietransfer, aufdecken.
Zum Beispiel wird in einer Zelle die Fluoreszenzlebensdauer durch die nähere Umgebung des Fluorophors beeinflusst, d. h. die Fluorophore können als Messsonden der Umgebung dienen.
Definition
Der Zerfall der Fluoreszenz folgt dabei einem exponentiellen Gesetz:
- .
mit
- der Fluoreszenzintensität unmittelbar nach einem Anregungsblitz (z. B. einem Laserimpuls)
- der verstrichenen Zeit .
Für die Fluoreszenzlebensdauer gilt
mit
- der Rate , mit der strahlende Prozesse zerfallen (engl. radiative)
- der Rate , mit der nicht-strahlende Prozesse zerfallen (engl. non-radiative).
Bei stark fluoreszierenden Stoffen wie Fluoreszenzfarbstoffen ist verschwindend gering:
Bei nicht-fluoreszierenden Stoffen hingegen (also den meisten Dingen unserer Umgebung) ist viel kleiner als :
Experimentelle Bestimmung
Die Ermittlung von Fluoreszenzlebensdauern erfordert die zeitaufgelöste Aufzeichnung der Intensität der emittierten Strahlung.
Zeitkorrelierte Einzelphotonenzählung
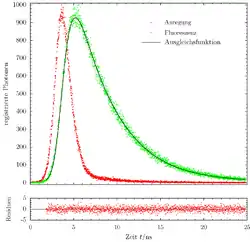
Ergebnis:
Ein gängiges Verfahren dafür ist die zeitkorrelierte Einzelphotonenzählung (TCSPC). Dabei erfolgt die Anregung der Probe periodisch mit monochromatischen Lichtblitzen geringer Intensität (Laser, Nanosekunden-Blitzlampe, Monochromator auf Emissionsseite der Versuchsanordnung). Die Detektion der Fluoreszenz erfolgt bei einer Wellenlänge, die größer ist als der zur Anregung verwendete, mit einem Sekundärelektronenvervielfacher (Photomultiplier / PMT), der einzelne Photonen registrieren kann. Wird das Licht der Anregungslichtquelle so stark abgeschwächt, dass nur noch nach ein bis fünf Prozent der Lichtblitze ein Signal registriert wird, so kann davon ausgegangen werden, dass es sich um die Registrierung einzelner Photonen handelt.
Mit einer elektronischen Schaltung werden Zeitmessungen durchgeführt, die von einem zusätzlichen Detektor (Photodiode) direkt an der Lichtquelle gestartet und vom Signal des Fluoreszenzdetektors gestoppt werden. Durch die Diskretisierung des Zeitsignals erhält man nach Durchlaufen vieler Anregungs-/Mess-Zyklen ein (von der Auflösung der eingesetzten Analog-Digital-Wandlers abhängiges) Histogramm (siehe Abbildung). Seine Einhüllende entspricht dem Signal einer analogen Aufzeichnung des zeitaufgelösten Intensitätsverlaufs der Fluoreszenz nach einem einzelnen Anregungsimpuls hoher Leistung. Aus dem Histogramm kann die Fluoreszenzlebensdauer graphisch oder durch Regressionsanalyse ermittelt werden.
Phasenfluorometrie
Eine andere Methode ist die Messung im Frequenzbereich (Phasenfluorometrie). Hierbei wird die Probe mit einem Licht bestrahlt, dessen Intensität mit der Kreisfrequenz moduliert wird (Formelzeichen E wie engl. excitation: Anregung). Detektiert wird das emittierte Fluoreszenzlicht , das mit der gleichen Frequenz, jedoch verringerter Amplitude moduliert ist. Es tritt eine Phasenverschiebung auf.
Das System lässt sich als eine lineare Antwortfunktion beschrieben:
mit
- der Suszeptibilität , die sich aus einem Dispersions- und einem Absorptionsterm zusammensetzt
- der Phase .
Wird nun als Antwort auf eine Delta-Störung im Zeitbereich eine Debye-Relaxation angenommen:
mit der Abklingzeit für die Demodulation,
dann folgt für den Frequenzbereich nach einer Fouriertransformation:
Für die Phase ergibt sich mit der Abklingzeit :
und für die Demodulation:
Im Falle nur eines Fluorophors sind und gleich und frequenzunabhängig: die Fluoreszenzlebensdauer.
Literatur
- Joseph R. Lakowicz: Principles of Fluorescence Spectroscopy. Plenum Publishing Corporation, 2. Ausgabe, 1999
- K. Suhling et al. - Imaging the Environment of Green Fluorescent Protein, Biophysical Journal (2002) 83, 3589–3595
- Primer on Time-Correlated Single Photon Counting, PicoQuant GmbH, Berlin.