Bimolekulare Fluoreszenzkomplementation
Die Bimolekulare Fluoreszenzkomplementation (engl. bimolecular fluorescence complementation, BiFC) ist ein Verfahren der Molekularbiologie zum Nachweis von Protein-Protein-Interaktionen. Das Verfahren basiert auf der Komplementation zweier nicht fluoreszierender Fragmente eines fluoreszierenden Proteins, wie beispielsweise grün fluoreszierendes Protein (GFP). Durch Zusammenlagerung der beiden Fragmente wird ein intakter, fluoreszierender Komplex erzeugt. Das Verfahren der bimolekularen Fluoreszkomplementation wurde maßgeblich von Tom Kerppola und Mitarbeitern entwickelt[1].
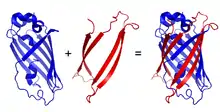
Prinzip
Das Prinzip der bimolekularen Fluoreszenzkomplementation ist verwandt mit Enzym-Fragment-Komplementationsverfahren und Zwei-Hybrid-Systemen. Zur Untersuchung von Protein-Protein-Interaktionen werden zwei verschiedene Fragmente eines fluoreszierenden Proteins an die zwei zu untersuchenden Proteine mit Hilfe molekularbiologischer Methoden angefügt. Eingesetzt werden üblicherweise Fragmente des gelb fluoreszierenden Proteins (YFP), welche aus den ersten (N-terminalen) 155 Aminosäuren bzw. den letzten (C-terminalen) 83 Aminosäuren bestehen, jedoch können auch abweichende Fragmente oder Fragmente anderer fluoreszierender Proteine verwendet werden,[2] Treten beide Fragmente als Folge einer Interaktion der zu untersuchenden, an die Fragmente gekoppelten Proteine in unmittelbarer Nähe, kann eine Zusammenlagerung und Komplementation zu einem intakten Gesamtrohprotein erfolgen, welches nach einer Maturation zur Fluoreszenz befähigt ist. Die Fluoreszenz kann mit Hilfe der Fluoreszenzmikroskopie oder der Fluoreszenzspektroskopie nachgewiesen und quantifiziert werden.
.png.webp)
Das Ausmaß der Komplementation ist maßgeblich von einem physischen Kontakt der komplementären Fragmente und somit von einer Interaktion der an sie gekoppelten Untersuchungsproteine abhängig. Da einmal gebildete BiFC-Komplexe stabil sind, lassen sich auch zeitlich kurze Interaktionen der untersuchten Proteine in lebenden Zellen nachweisen[3]. Im Gegensatz zu den auf Resonanzenergietransfer basierenden Verfahren FRET und BRET erlaubt die bimolekulare Fluoreszenzkomplementation, bedingt durch die langsame Maturation fluoreszierender Proteine, keine zeitaufgelöste Untersuchung von molekularen Interaktionen. Als limitierend für die Anwendung der bimolekularen Fluoreszenzkomplementation gelten die Position der Untersuchungsprotein-Fluoreszenzproteinfragment-Kopplung, die entscheidend für eine Komplementation sein kann, und die Selbstkomplementationsrate der Fluoreszenzproteinfragmente, die zu falsch positiven Interpretationen führen kann.
Variationen
Neuere Varianten basieren auf einer Komplementation von Fragmenten verschiedenfarbiger Fluoreszenzproteine, wodurch gleichzeitig mehrere Protein-Protein-Interaktionen nachgewiesen werden können (Multicolor-Fluoreszenzkomplementation)[2]. Durch Kombination der bimolekularen Fluoreszenzkomplementation mit FRET oder BRET können auch tri- oder oligomere Proteinkomplexe nachgewiesen werden[4].
Einzelnachweise
- Hu CD, Chinenov Y, Kerppola TK: Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation. In: Molecular cell. 9, Nr. 4, April 2002, S. 789–98. PMID 11983170.
- Hu CD, Kerppola TK: Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. In: Nature biotechnology. 21, Nr. 5, Mai 2003, S. 539–45. doi:10.1038/nbt816. PMID 12692560. PMC 1820765 (freier Volltext).
- Kerppola TK: Bimolecular fluorescence complementation (BiFC) analysis as a probe of protein interactions in living cells. In: Annual review of biophysics. 37, 2008, S. 465–87. doi:10.1146/annurev.biophys.37.032807.125842. PMID 18573091.
- Shyu YJ, Suarez CD, Hu CD: Visualization of ternary complexes in living cells by using a BiFC-based FRET assay. In: Nature Protocols. 3, Nr. 11, 2008, S. 1693–1702. doi:10.1038/nprot.2008.157. PMID 18846096.