Fluoreszenzlebensdauer-Mikroskopie
Die Fluoreszenzlebensdauer-Mikroskopie (englisch fluorescence lifetime imaging microscopy, FLIM) ist ein Fluoreszenz-basiertes bildgebendes Verfahren der Mikroskopie. Im Gegensatz zu anderen fluoreszenzmikroskopischen Verfahren beruht sie nicht auf einer Messung der Fluoreszenzintensität, sondern auf der Messung der unterschiedlichen Lebensdauern der angeregten Zustände fluoreszierender Moleküle.
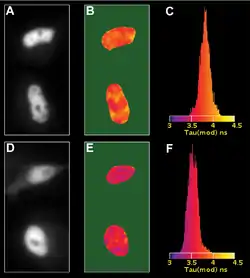
Die Aufnahmen zeigen eingefärbte Zellkerne.
Die Abnahme der Fluoreszenzlebensdauern in der unteren Reihe, bedingt durch die Zugabe eines weiteren Fluoreszenzfarbstoffes, deutet auf einen Förster-Resonanzenergietransfer hin.
Die Fluoreszenzlebensdauer-Mikroskopie wird insbesondere in Verbindung mit der Konfokalmikroskopie und der Multiphotonenmikroskopie angewendet.
Physikalische Grundlage
Die Fluoreszenzlebensdauer-Mikroskopie beruht auf einer Messung der Fluoreszenzlebensdauer angeregter fluoreszierender Moleküle. Die Fluoreszenzlebensdauer ist dabei die mittlere Zeit , die ein Molekül im angeregten Zustand verbleibt, bevor es unter Abgabe eines Photons in seinen Grundzustand zurückkehrt. Der Fluoreszenzabbau spiegelt sich in einer exponentiellen Abnahme der Fluoreszenzintensität mit der Zeit t wieder:
mit
- der initialen Fluoreszenzintensität zur Zeit .
Zugleich ist die Fluoreszenzlebensdauer umgekehrt proportional zur Summe der Zerfallsraten k für strahlende und nichtstrahlende Prozesse:
Die Fluoreszenzlebensdauer eines Farbstoffs hängt u. a. ab von seiner Identität und seiner chemischen Umgebung. Sie wird durch Energietransfermechanismen wie den Förster-Resonanzenergietransfer beeinflusst. Die Fluoreszenzlebensdauer ist jedoch unabhängig von der initialen Fluoreszenzintensität.
Verfahren
Die Fluoreszenzlebensdauer-Mikroskopie liefert Bilder mit der Fluoreszenzlebensdauer für jedes Pixel des Bildes. Die Messung der Fluoreszenzlebensdauer in der Fluoreszenzlebensdauer-Mikroskopie beruht entweder auf einer gepulsten Anregung und einer Messung des zeitlichen Fluoreszenzabfalls, oder auf einer intensitätsmodulierten Anregung und einer Messung der Phasenverschiebung.
Gepulste Anregung
Die theoretisch einfachste Methode zur Bestimmung der Fluoreszenzlebensdauer besteht in der Zählung freigesetzter Photonen mit Hilfe der zeitkorrelierten Einzelphotonenzählung (englisch time-correlated single photon counting, TCSPC), nach periodischer Anregung mit kurzen Lichtimpulsen im Picosekundenbereich, also deutlich kürzer als typische Fluoreszenzlebensdauern (Nanosekundenbereich).
Bei ausreichend kurzer Anregung kann dann für die meisten Proben die zeitabhängige exponentielle Abnahme der Fluoreszenzintensität beobachtet werden, aus der die Fluoreszenzlebensdauer bestimmt werden kann. Dazu wird die Anregungsintensität soweit herabgesetzt, dass pro Anregungspuls nur etwa ein Photon detektiert wird. Für dieses lässt sich die Zeit zwischen Anregungspuls und Photon mit einer Genauigkeit von einigen Picosekunden messen. Aus vielen solchen Einzelmessungen wird dann ein Histogramm erstellt, aus dem die Fluoreszenzlebensdauer direkt bestimmt werden kann.
Dieses Verfahren hat außerdem den Vorteil, dass es von Schwankungen der Anregungsintensität unabhängig ist.
Phasenmodulierung
Mit Hilfe der Phasenfluorimetrie kann die Fluoreszenzlebensdauer über die Phasenverschiebung der Fluoreszenz nach einer intensitätsmodulierten Anregung bestimmt werden. Die Anregungsintensität (engl. excitation: Anregung) wird hierbei sinusförmig moduliert, z. B. mit Hilfe eines akustooptischen Modulators:
mit
- der Kreisfrequenz ω der Modulation
- der Amplitude mE der Modulation.
Das Signal der Fluoreszenzintensität folgt dem Anregungssignal zeitversetzt:
mit
- dem Ort der Detektion, also dem Pixel x, y
- dem Versatz (als Phase φF), der den zeitlich begrenzten Verbleib des Fluoreszenzfarbstoffs im angeregten Zustand beschreibt
- der Modulationsamplitude mF, die gegenüber mE reduziert ist.
Die Fluoreszenzlebensdauer kann dann auf zwei Arten bestimmt werden:
- über die Phase:
- über die Amplitudenänderung: .
Zur Detektion können hier Bildsensoren (CCD-Kameras, Avalanche-Photodioden-Felder[1]) eingesetzt werden, bei denen die Zeit, in der sie sensitiv sind, fein gesteuert werden kann. Bei ICCD-Kameras erfolgt dies z. B. über Bildverstärker aus Mikrokanalplatten, deren Verstärkung durch dasselbe Signal moduliert werden kann, das zur Steuerung der Beleuchtung benutzt wird (gated CCD). Dann werden Aufnahmen gemacht, bei denen Detektion und Anregung unterschiedlich zueinander phasenverschoben sind; aus diesen wird ein Bild der Fluoreszenzlebensdauern rekonstruiert.[2]
Literatur
- Theodorus W. J. Gadella: FRET and FLIM techniques. Elsevier, Amsterdam 2009, ISBN 978-0-08-054958-3.
- A. Periasamy, R. M. Clegg: Flim Microscopy in Biology and Medicine. CRC Press, 2010, ISBN 978-1-4200-7890-9.
Weblinks
- Applications in Confocal Microscopy: Fluorescence Lifetime Imaging Microscopy (FLIM). Olympus Corporation, archiviert vom Original am 20. Dezember 2011; abgerufen am 3. April 2010 (englisch).
- Application Note: Two-photon fluorescence lifetime imaging (2P-FLIM) for ion sensing in living cells (PDF; 831 kB) PicoQuant GmbH 2008
- Application Note: Quantitative in vivo imaging of molecular distances using FLIM-FRET (PDF; 764 kB) PicoQuant GmbH 2009
- Principle of TCSPC FLIM (Becker & Hickl, website)
- Molecular Imaging with FLIM (Becker & Hickl, website)
Einzelnachweise
- Day-Uei Li, Jochen Arlt, Justin Richardson, Richard Walker, Alex Buts, David Stoppa, Edoardo Charbon, Robert Henderson: Real-time fluorescence lifetime imaging system with a 32 × 32 0.13µm CMOS low dark-count single-photon avalanche diode array. In: Optics Express. Band 18, Nr. 10, 2010, ISSN 1094-4087, S. 10257–10269, doi:10.1364/OE.18.010257.
- Joseph R. Lakowicz, Klaus W. Berndt: Lifetime-selective fluorescence imaging using an rf phase-sensitive camera. In: Review of Scientific Instruments. Band 62, Nr. 7, 1991, ISSN 0034-6748, S. 1727, doi:10.1063/1.1142413.