Hephästin
Hephästin (Gen: HEPH) ist ein homologes Enzym des Caeruloplasmin, ein Membranprotein, das in allen Neumündern vorkommt. Beim Menschen ist es in Brust, Darm, Knochenbälkchen der Substantia spongiosa und Fibroblasten lokalisiert. Es oxidiert, als Ferroxidase, das von Enterozyten importierte Eisen(II) zu Eisen(III) und bereitet es für den Export durch das Ferroportin vor. Hephästin ist damit zusammen mit dem Ferroportin für den Efflux von Eisenionen aus der Zelle verantwortlich. Damit ist es unverzichtbar im Eisen-Stoffwechsel bei der Eisenaufnahme durch den Darm. Möglicherweise transportiert es auch Kupfer.
| Hephästin | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 1136 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer; single pass Typ 1 Membranprotein | |
| Kofaktor | 6 Kupfer | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Namen | HEPH KIAA0698 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.-.-.-, Oxidoreduktase | |
| Reaktionsart | Oxidation | |
| Substrat | 4 Fe2+ + 4 H+ + O2 | |
| Produkte | 4 Fe3+ + 2 H2O | |
| Vorkommen | ||
| Homologie-Familie | Ferroxidase-like | |
| Übergeordnetes Taxon | Neumünder | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 9843 | 15203 |
| Ensembl | ENSG00000089472 | ENSMUSG00000031209 |
| UniProt | Q9BQS7 | Q9Z0Z4 |
| Refseq (mRNA) | NM_001130860 | NM_001159627 |
| Refseq (Protein) | NP_001124332 | NP_001153099 |
| Genlocus | Chr X: 66.16 – 66.27 Mb | Chr X: 96.46 – 96.57 Mb |
| PubMed-Suche | 9843 | 15203 |
Das Protein ist nach dem griechischen Gott Hephaistos (Schmied) benannt.[1][2][3]
Pathologie
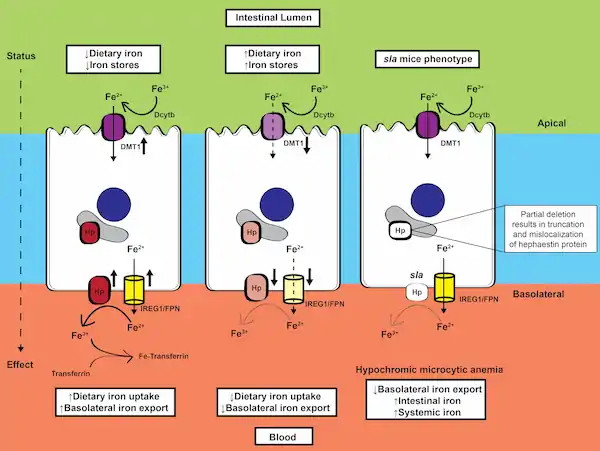
Kupfer ist essenziell notwendig für die Stabilität von Hephästin. Mäuse ganz ohne Caeruloplasmin und Hephästin zeigen alle Symptome der Makuladegeneration. Erhöhte Eisenkonzentrationen in der Substantia nigra bei Parkinsonkrankheit sind wahrscheinlich auf erniedrigte Aktivität von Hephästin und Ferroportin zurückzuführen.[4][5][6][7]
Regulation
Erythropoetin erhöht die Hephästinexpression und Eisenabsorption im Duodenum bzw. aus dem intestinalen Lumen. Eine eisenhaltige Diät erhöhte bei Ratten die Expression von Caeruloplasmin und Ferroportin, nicht jedoch von Hephästin. In Darmzellen ist der Übergang ins Krebsstadium mit einer erhöhten Eiseneinfuhr und vermindertem Export (Hephästinaktivität) verknüpft.[8][9][10]
Einzelnachweise
- UniProt Q9BQS7
- Griffiths TA, Mauk AG, MacGillivray RT: Recombinant expression and functional characterization of human hephaestin: a multicopper oxidase with ferroxidase activity. In: Biochemistry. 44, Nr. 45, November 2005, S. 14725–31. doi:10.1021/bi051559k. PMID 16274220.
- Ma Y, Yeh M, Yeh KY, Glass J: Iron Imports. V. Transport of iron through the intestinal epithelium. In: Am. J. Physiol. Gastrointest. Liver Physiol.. 290, Nr. 3, März 2006, S. G417–22. doi:10.1152/ajpgi.00489.2005. PMID 16474007.
- Chen H, Huang G, Su T, et al: Decreased hephaestin activity in the intestine of copper-deficient mice causes systemic iron deficiency. In: J. Nutr.. 136, Nr. 5, Mai 2006, S. 1236–41. PMID 16614410.
- Hadziahmetovic M, Dentchev T, Song Y, et al: Ceruloplasmin/hephaestin knockout mice model morphologic and molecular features of AMD. In: Invest. Ophthalmol. Vis. Sci.. 49, Nr. 6, Juni 2008, S. 2728–36. doi:10.1167/iovs.07-1472. PMID 18326691.
- Qian ZM, Chang YZ, Zhu L, et al: Development and iron-dependent expression of hephaestin in different brain regions of rats. In: J. Cell. Biochem.. 102, Nr. 5, Dezember 2007, S. 1225–33. doi:10.1002/jcb.21352. PMID 17516501.
- Wang J, Jiang H, Xie JX: Ferroportin1 and hephaestin are involved in the nigral iron accumulation of 6-OHDA-lesioned rats. In: Eur. J. Neurosci.. 25, Nr. 9, Mai 2007, S. 2766–72. doi:10.1111/j.1460-9568.2007.05515.x. PMID 17561842.
- Kong WN, Chang YZ, Wang SM, et al: Effect of erythropoietin on hepcidin, DMT1 with IRE, and hephaestin gene expression in duodenum of rats. In: J. Gastroenterol.. 43, Nr. 2, 2008, S. 136–43. doi:10.1007/s00535-007-2138-5. PMID 18306987.
- Qian ZM, Chang YZ, Leung G, et al: Expression of ferroportin1, hephaestin and ceruloplasmin in rat heart. In: Biochim. Biophys. Acta. 1772, Nr. 5, Mai 2007, S. 527–32. doi:10.1016/j.bbadis.2007.02.006. PMID 17383861.
- Brookes MJ, Hughes S, Turner FE, et al: Modulation of iron transport proteins in human colorectal carcinogenesis. In: Gut. 55, Nr. 10, Oktober 2006, S. 1449–60. doi:10.1136/gut.2006.094060. PMID 16641131.