Clathrin
Clathrin ist ein Protein, das an der Einstülpung von Zellmembranen und der Bildung von Vesikeln beteiligt ist (vor allem bei der Clathrin-vermittelten Endozytose). Nach dem Abschnüren wird das Clathrin der Stachelsaumbläschen (clathrin-coated vesicles) ATP-abhängig entfernt („uncoating“ durch die uncoating-ATPase).
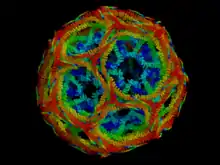
Clathrin ist ein außergewöhnlich strukturiertes Protein. Es ist ein Hexamer aus drei schweren und drei leichten Untereinheiten, von denen es je zwei Isoformen gibt. Die Untereinheiten sind in Form eines Dreibeins angeordnet, in Form von Triskelions. Somit ist es möglich, ein zweidimensionales Netzwerk zu bilden, das sich aus Hexagonen und Pentagonen zusammensetzt. Es wird keine flache Ebene erzeugt, sondern ein Konstrukt mit einer konvexen und einer konkaven Seite. Die konkave Seite liegt immer der Membran zugewandt.
Die Clathrin-Vesikel haben Durchmesser von 50 bis 100 nm und werden von einem Gerüst aus meistens 12 Penta- und 8 Hexagonen aus insgesamt 36 Dreifachskeletten von Clathrin überzogen. Dieses fibröse Protein besteht aus einer schweren Kette (180.000 Dalton [Da]) und einer leichten Kette (35.000 bis 40.000 Da). Außerdem kommt das 900 Aminosäuren-lange Dynamin, das GTP binden und hydrolysieren kann, auch im Vesikelmantel vor. Zwischen dem Clathrin und der äußeren Vesikelmembran finden sich sogenannte Adaptorproteinkomplexe (engl. adaptor protein complexes), abgekürzt AP-Komplexe. Diese Komplexe, AP-1 bis AP-4 (≈340.000 Da), bestehen aus je vier unterschiedlichen Polypeptiden, sind also Heterotetramere. Sie binden an die schweren Ketten des Clathrins, Membranlipide sowie Membranproteine und vermitteln dadurch die Clathrin-Bindung an Membranen. AP-2 vermittelt die Bildung von clathrin-coated vesicles (CCV) an der Plasmamembran. AP-1 vermittelt CCV-Bildung am trans-Golgi-Netzwerk, dem letzten Kompartiment des Proteinsyntheseapparates im sekretorischen Transportweg.
Clathrin und Membrankrümmung
Grundständige Lehrbücher der Zellbiologie benennen Clathrin als das Protein, welches für die Krümmung der Membran bei der Vesikelbildung verantwortlich ist. Es wurde ursprünglich angenommen, dass die Assemblierung der Clathrin-Proteine zur Triskelion-Struktur die Membran in den gekrümmten Zustand "zwingt". Neuere Erkenntnisse zeigen jedoch, dass für die effektive Krümmung der Membran in vivo weitere Faktoren eine wichtige Rolle spielen. Dazu gehört z. B. die Aktivität von ATP-abhängigen Flippasen, die eine lokal verstärkte Asymmetrie der Phospholipid-Zusammensetzung in der Membran erzeugen. Die intrinsische Eigenschaft bestimmter Phospholipide, Membranen zu krümmen, führt dann zur Ausstülpung. Auch die an der Hüllenbildung beteiligte kleine GTPase Arf hat bereits einen Einfluss auf die Membrankrümmung. Es ist daher das Zusammenspiel mehrerer komplexer Faktoren, die eine effektive Bildung von clathrin-coated vesicles ermöglichen.
Weblinks
Literatur
- Todd R. Graham, Michael M. Kozlov: Interplay of proteins and lipids in generating membrane curvature. In: Current Opinion in Cell Biology. 22, 2010, S. 430–436, doi:10.1016/j.ceb.2010.05.002.
- E. Cocucci, F. Aguet, S. Boulant, T. Kirchhausen: The first five seconds in the life of a clathrin-coated pit. In: Cell. Band 150, Nummer 3, August 2012, S. 495–507. ISSN 1097-4172. doi:10.1016/j.cell.2012.05.047. PMID 22863004. PMC 3413093 (freier Volltext).