Pentamethylcyclopentadien
1,2,3,4,5-Pentamethylcyclopentadien ist ein cyclisches Alken bzw. ein fünffach methyliertes Derivat des Cyclopentadien (Cp).[3] 1,2,3,4,5-Pentamethylcyclopentadien ist der Präkursor des Liganden 1,2,3,4,5-Pentamethylcyclopentadienyl (C5Me5−), der oft mit Cp* abgekürzt wird; der Stern steht für die fünf strahlenförmig angeordneten Methylgruppen. Cp* ist ein wichtiges Reagenz in der metallorganischen Chemie. Im Gegensatz zu weniger substituierten Cyclopentadien-Derivaten neigt Pentamethylcyclopentadien nicht zu Dimerisierung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
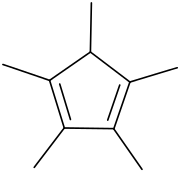 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pentamethylcyclopentadien | |||||||||||||||
| Summenformel | C10H16 | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 136,24 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,84 g·cm−3 (20 °C)[2] | |||||||||||||||
| Siedepunkt |
58 °C (17 hPa)[2] | |||||||||||||||
| Brechungsindex |
1,474 (20 °C, 589 nm)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Synthese
Pentamethylcyclopentadien ist kommerziell erhältlich. Erstmals wurde es aus trans-2-Methyl-2-butenal über 2,3,4,5-Tetramethylcyclopent-2-enon dargestellt.[4]
Alternativ kann 2-Butenyllithium mit Ethylacetat umgesetzt werden, gefolgt von einer säurekatalysierten Dehydrozyklisierung: [5][6]
- 2 MeCH=C(Li)Me + MeC(O)OEt → (MeCH=C(Me))2C(OLi)Me + LiOEt
- (MeCH=C(Me))2C(OLi)Me + H+ → Cp*H + H2O + Li+
Organometallische Derivate
Pentamethylcyclopentadien ist ein bedeutender Prekursor für metallorganische Verbindungen. Die anionische Form Pentamethylcyclopentadienyl eignet sich aufgrund einer Bindung der fünf ringständigen Kohlenstoffatome an das Metallatom als Ligand.[7]
Synthese von Cp*-Komplexen
| Repräsentative Cp*-Metallkomplexe | |
|---|---|
| Cp*2Fe | gelb |
| Cp*TiCl3 | rot |
| [Cp*Fe(CO)2]2 | rot-violett |
| [Cp*RhCl2]2 | rot |
| [Cp*IrCl2]2 | orange |
| Cp*Re(CO)3 | farblos |
| Cp*Mo(CO)2CH3 | orange |
Einige beispielhafte Reaktionen für die Synthese von verbreiteten Cp*-Metallkomplexen (siehe Tabelle) sind:[8]
Ein in der Lehre verwendeter aber veralteter Weg zur Synthese von Cp*-Komplexen verwendet Hexamethyl-Dewar-Benzol. Diese Methode wurde traditionell zur Herstellung von Chlor-verbrückten [Cp*IrCl2]2- und [Cp*RhCl2]2-Dimeren benutzt. Die Synthese basiert auf einer Halogenwasserstoffsäuren-induzierten Umlagerung von Hexamethyl-Dewar-Benzol[9][10] zu einem substituierten Pentamethylcyclopentadien und der anschließenden Reaktion mit Iridium(III)-chlorid-Hydrat[11] oder Rhodium(III)-chlorid-Hydrat.[12]
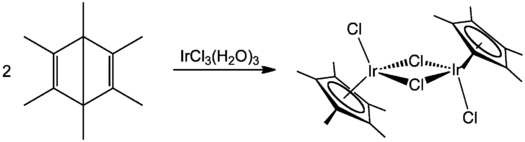
Vergleich zwischen Cp* und Cp
Pentamethylcyclopentadienyl-Komplexe unterscheiden sich in mehrfacher Hinsicht von den weiter verbreiteten Cyclopentadienyl-Derivaten. Als elektronenreicherer Ligand ist Cp* ein stärkerer Donor und weniger leicht vom Metall-Zentralatom zu entfernen. Hieraus resultiert eine höhere thermische Stabilität von Cp*-Komplexen. Sein sterischer Anspruch ermöglicht die Isolierung von Komplexen mit fragilen Liganden, reduziert intermolekulare Wechselwirkungen und verringert die Tendenz zu oligomeren bzw. polymeren Strukturen. Cp*-Komplexe sind in der Regel auch in unpolaren Lösungsmitteln sehr gut löslich.[13]
Einzelnachweise
- Eintrag zu 1,2,3,4,5-Pentamethylcyclopentadien bei ChemicalBook, abgerufen am 20. Januar 2014.
- Datenblatt 1,2,3,4,5-Pentamethylcyclopentadien (PDF) bei Merck, abgerufen am 29. Dezember 2012.
- Overview of Cp* Compounds: Elschenbroich, C. and Salzer, A. Organometallics: a Concise Introduction (1989) p. 47
- L. de Vries: Preparation of 1,2,3,4,5-Pentamethyl-cyclopentadiene, 1,2,3,4,5,5-Hexamethyl-cyclopentadiene, and 1,2,3,4,5-Pentamethyl-cyclopentadienylcarbinol. In: J. Org. Chem.. 25, Nr. 10, 1960, S. 1838. doi:10.1021/jo01080a623.
- S. Threlkel, J. E. Bercaw, P. F. Seidler, J. M. Stryker, R. G. Bergman: 1,2,3,4,5-Pentamethylcyclopentadiene In: Organic Syntheses. 65, 1987, S. 42, doi:10.15227/orgsyn.065.0042; Coll. Vol. 8, 1993, S. 505 (PDF).
- Fendrick, C. M.; Schertz, L. D.; Mintz, E. A.; Marks, T. J.: Large-Scale Synthesis of 1,2,3,4,5-Pentamethylcyclopentadiene. In: Inorganic Syntheses. 29, 1992, S. 193–198. doi:10.1002/9780470132609.ch47.
- Yamamoto, A. Organotransition Metal Chemistry: Fundamental Concepts and Applications. (1986) p. 105
- R. B. King, M. B. Bisnette: Organometallic chemistry of the transition metals XXI. Some π-pentamethylcyclopentadienyl derivatives of various transition metals. In: Journal of Organometallic Chemistry. 8, Nr. 2, 1967, S. 287–297. doi:10.1016/S0022-328X(00)91042-8.
- L. A. Paquette, G. R. Krow: Electrophilic Additions to Hexamethyldewarbenzene. In: Tetrahedron Lett.. 9, Nr. 17, 1968, S. 2139–2142. doi:10.1016/S0040-4039(00)89761-0.
- R. Criegee, H. Gruner: Acid-catalyzed Rearrangements of Hexamethyl-prismane and Hexamethyl-Dewar-benzene. In: Angew. Chem. Int. Ed. Engl.. 7, Nr. 6, 1968, S. 467–468. doi:10.1002/anie.196804672.
- J. W. Kang, K. Mosley, P. M. Maitlis: Mechanisms of Reactions of Dewar Hexamethylbenzene with Rhodium and Iridium Chlorides. In: Chem. Commun.. Nr. 21, 1968, S. 1304–1305. doi:10.1039/C19680001304.
- J. W. Kang, P. M. Maitlis: Conversion of Dewar Hexamethylbenzene to Pentamethylcyclopentadienylrhodium(III) Chloride. In: J. Am. Chem. Soc.. 90, Nr. 12, 1968, S. 3259–3261. doi:10.1021/ja01014a063.
- B. D. Gupta, A. J. Elias: Basic Organometallic Chemistry. Universities Press, Hyderabad 2010, ISBN 978-1-4398-4968-2, S. 101–102.
