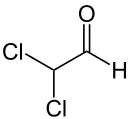
Dichloracetaldehyd
Dichloracetaldehyd ist eine chemische Verbindung aus der Gruppe der Aldehyde. Er ist neben dem Monochloracetaldehyd und Trichloracetaldehyd einer der drei möglichen chlorierten Acetaldehyde.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dichloracetaldehyd | |||||||||||||||
| Andere Namen |
2,2-Dichloracetaldehyd | |||||||||||||||
| Summenformel | C2H2Cl2O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 112,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,4 g/ml[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
88 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
leicht in Wasser (140 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Dichloracetaldehyd kann durch Chlorierung von Acetaldehyd oder Paraldehyd gewonnen werden. Die Hypochlorierung von 1,2-Dichlorethylen mittels Chlor und Wasser liefert reinen Dichloracetaldehyd.[2][3]
Eigenschaften
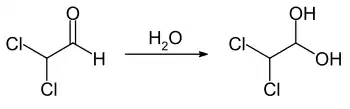
Dichloracetaldehyd ist eine leicht flüchtige, Flüssigkeit, die in Wasser unter Hydratbildung leicht löslich ist. In Wasser wird ein auch als Monohydrat bezeichnetes Diol, chemisch 2,2-Dichlor-1,1-ethandiol, gebildet.[2] Diese Verbindung bildet farblose Kristalle, die zwischen 35 und 50 °C schmelzen und bei 85 bis 95 °C sieden.[2]
Die Verbindung zersetzt sich bei Erhitzung.[1] In Gegenwart von Lewis-Säuren wie Antimontrichlorid, Eisen(III)-chlorid, Aluminiumtrichlorid, Zinn(IV)-chlorid oder Bortrifluorid kann das Trimere Hexachlorparaldehyd (2,4,6-Tris(dichlormethyl)-1,3,5-trioxan) erhalten werden.[2] Das Trimer bildet farblose Kristalle, die bei 131–132 °C schmelzen. Am Siedepunkt bei 210–220 °C erfolgt eine langsame Rückbildung von Dichloracetaldehyd.[2]

Verwendung
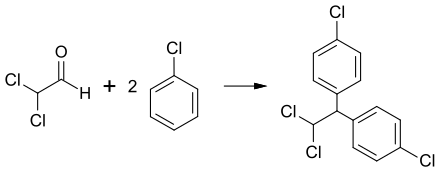
Dichloracetaldehyd wird zur Produktion von anderen chemischen Verbindungen wie Mitotan verwendet.[4] Die Kondensation mit Chlorbenzol ergibt p,p′-Dichlor-1,1-diphenyl-2,2-dichlorethan, welches früher als Insektizid verwendet wurde.[2]
Sicherheitshinweise
Die Dämpfe von Dichloracetaldehyd können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 60 °C) bilden.[1]
Einzelnachweise
- Eintrag zu Dichloracetaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Jira, R.; Kopp, E.; McKusick, B.C.; Röderer, G.; Bosch, A.; Fleischmann, G.: Chloroacetaldehydes in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a06_527.pub2.
- Eintrag zu Dichloroacetaldehyde in der Hazardous Substances Data Bank, abgerufen am 21. April 2015 (online auf PubChem).
- Wiley-VCH: Ullmann's Fine Chemicals, 3 Volume Set:. John Wiley & Sons, 2014, ISBN 978-3-527-68359-8, S. 133 (eingeschränkte Vorschau in der Google-Buchsuche).



