Carboxymethyldethia-CoA
Carboxymethyldethia-CoA (üblicherweise abgekürzt als CMX) ist ein synthetisches Acetyl-CoA-Analogon, das in der Lage ist, das Enzym Citrat-Synthase zu hemmen, welches eine zentrale Rolle im Citratzyklus spielt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Carboxymethyldethia-CoA | ||||||||||||
| Andere Namen |
CMX | ||||||||||||
| Summenformel | C23H38N7O18P3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 793,51 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Struktur
Die chemische Struktur des CMX hat große Ähnlichkeit mit der des Acetyl-CoA. Die einzigen Unterschiede betreffen die für die Funktion maßgebliche β-Mercaptoethylamineinheit: An Stelle des Schwefelatoms der Thioestergruppe von Acetyl-CoA befindet sich bei CMX eine Methylengruppe und an Stelle der Acetylgruppe eine Carboxylgruppe.

Inhibitorwirkung
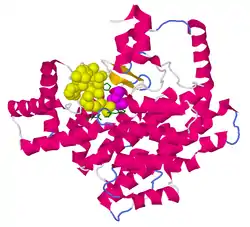
CMX bindet an die gleiche Stelle des aktiven Zentrums der Citrat-Synthase wie das Coenzym Acetyl-CoA. Dort spielen drei Aminosäuren des Enzyms eine bedeutende Rolle für die Katalyse: His-274, Asp-375 und His-320. Im etablierten Mechanismus für die Acetylierung des Substrats wird die schwach CH-acide Methylgruppe von Acetyl-CoA deprotoniert und das freigesetzte H+ vom Asp-375 abstrahiert, wobei die dabei entstehende Enolatform zusätzliche Stabilisierung durch His-274 erfährt.[2] Eine solche Enolatbildung ist im Falle der Carbonsäure CMX nicht möglich. Stattdessen deuten NMR- und Röntgenstrukturanalyse darauf hin, dass hier ein partieller Protonenaustausch zwischen den Carboxylgruppen von CMX und Asp-375 stattfindet, deren Säurekonstanten sehr ähnlich sind, was zu einer ungewöhnlich kurzen Wasserstoffbrückenbindung zwischen den beiden Gruppen führt. Bei zu niedrigem pH-Wert sind beide Carboxylgruppen protoniert und die kurze Wasserstoffbrückenbindung kann sich nicht ausbilden, wodurch der Ki-Wert – und damit die enzymhemmende Wirkung – stark absinkt.[3][4]
Die enzymhemmende Wirkung beruht darauf, dass CMX als Übergangszustandanalogon an Stelle des physiologischen Coenzyms Acetyl-CoA an die Citrat-Synthase bindet. Da es im Gegensatz zu letzterem über keine aktivierte Acetylgruppe verfügt, kann es nicht die physiologische Wirkung entfalten, das Substrat des Enzyms zu acetylieren, wodurch die Enzymfunktion unterbunden wird.[3]
Synthese
CMX kann im Labor über einen Reaktionsweg dargestellt werden, der Methoden der Biochemie und der Organischen Chemie verbindet. Hierfür wird zunächst aus Pantothensäure in einer dreistufigen Synthese ein Substrat hergestellt, das anschließend mithilfe von Coenzym-A-Synthase aus Brevibacterium ammoniagenes zu einem CoA-Analogon umgesetzt wird, welches im Vergleich zu CoA anstelle der äußeren Amid- eine Thioesterbindung enthält.[5] Aminolyse des Thioesters mit γ-Aminobuttersäure liefert schließlich das Produkt Carboxymethyldethia-CoA.[3]
Analytik
CMX kann anhand seines 1H- und 13C-NMR-Spektrums sowie mithilfe hochauflösender Massenspektrometrie nach Elektrospray-Ionisation identifiziert werden.[6]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemie. Springer-Verlag, Berlin/Heidelberg 2013, ISBN 978-3-8274-2988-9, S. 508–510.
- Ken C. Usher, S. James Remington, David P. Martin, Dale G. Drueckhammer: A Very Short Hydrogen Bond Provides Only Moderate Stabilization of an Enzyme-Inhibitor Complex of Citrate Synthase. In: Biochemistry 1994, Band 33, S. 7753–7759. doi:10.1021/bi00191a002.
- Zhengtian Gu, Dale G. Drueckhammer, Linda Kurz, Kai Liu, David P. Martin, Ann McDermott: Solid State NMR Studies of Hydrogen Bonding in a Citrate Synthase Inhibitor Complex. In: Biochemistry, 1999, Band 38, S. 8022–8031. doi:10.1021/bi9813680.
- David P. Martin, Dale G. Drueckhammer: Combined Chemical and Enzymatic Synthesis of Coenzyme A Analogs. In: Journal of the American Chemical Society, 1992, Band 114, Nr. 18, S. 7287–7288. doi:10.1021/ja00044a045.
- Julie A. Francois, Courtney M. Starks, Sasitorn Sivanuntakorn, Hong Jiang, Aaron E. Ransome, Jeong-Won Nam, Charles Z. Constantine, T. Joseph Kappock: Structure of a NADH-Insensitive Hexameric Citrate Synthase that Resists Acid Inactivation. In: Biochemistry, 2006, Band 45, Nr. 45, S. 13487–13499. Supp. Inf., S. 4–5. doi:10.1021/bi061083k.