Balmer-Serie
Als Balmer-Serie wird eine bestimmte Folge von Emissions-Spektrallinien im sichtbaren elektromagnetischen Spektrum des Wasserstoffatoms bezeichnet, deren unteres Energieniveau in der L-Schale liegt. Sie wird beim Übergang eines Elektrons von einem höheren zum zweittiefsten Energieniveau emittiert.
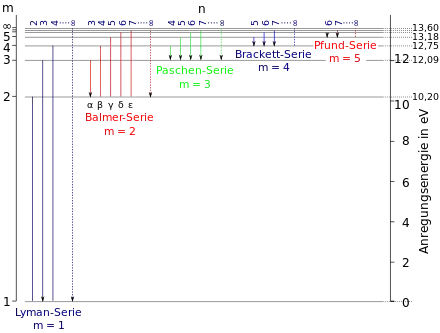
Weitere Serien sind die Lyman-, Paschen-, Brackett-, Pfund- und die Humphreys-Serie.
Spektrum

Die Spektrallinien der Balmer-Serie sind nach dem Schweizer Physiker Johann Jakob Balmer benannt, der 1885 ihre mathematische Gesetzmäßigkeit, die Balmer-Formel, erkannte.
Entdeckung
Im sichtbaren Bereich des Wasserstoffatom-Spektrums lassen sich vier Linien beobachten, deren Abstände voneinander mit abnehmender Wellenlänge kleiner werden. Sie werden, beginnend mit der größten Wellenlänge, als Hα (H-alpha), Hβ, Hγ und Hδ bezeichnet. Ihre Wellenlängen lassen sich mit der Balmer-Formel berechnen:
ist dabei eine empirische Konstante (, also eine Wellenlänge im Ultravioletten). Für sind die ganzen Zahlen 3, 4, 5 und 6 einzusetzen (); ist die fortlaufende Nummer der Schale, die Hauptquantenzahl, des betreffenden angeregten Zustands.
In dem für das menschliche Auge nicht sichtbaren ultravioletten Bereich des Spektrums wurden weitere Linien entdeckt, die fortlaufend mit Hε, Hζ usw. bezeichnet werden und deren Wellenlängen sich für ganzzahlige oberhalb 6 ebenfalls sehr gut berechnen lassen:
| Übergang von nach | 3 → 2 | 4 → 2 | 5 → 2 | 6 → 2 | 7 → 2 | 8 → 2 | 9 → 2 | → 2 |
| Name der Linie | Hα | Hβ | Hγ | Hδ | Hε | Hζ | Hη | |
| Wellenlänge in nm gemessen | 656,2793 | 486,1327 | 434,0466 | 410,1738 | 397,0075 | 388,8052 | 383,5387 | |
| Wellenlänge in nm berechnet | 656,278 | 486,132 | 434,045 | 410,1735 | 397,0074 | 388,8057 | 383,5397 | (364,56) |
| Farbe | Rot | Blau-Grün | Violett | Violett | Violett | Violett | Ultraviolett | Ultraviolett |
| Sichtbarkeit (für das menschliche Auge) | sichtbar | nicht sichtbar | ||||||
Die Folge konvergiert also für wachsende von oben gegen die Wellenlänge .
Verallgemeinerung durch Rydberg
Stellt man die Balmer-Formel nach dem Kehrwert der Wellenlänge, der Wellenzahl
um, lässt die von Balmer gefundene Gleichung sich mit auch in der Form
schreiben, in der
die nach dem schwedischen Physiker Johannes Rydberg benannte Rydberg-Konstante ist und für beliebige natürliche Zahlen größer als 2 einzusetzen sind. Bereits drei Jahre nach Balmers Entdeckung verallgemeinerte daher Rydberg Balmers Formel im Jahre 1888 zu der ebenfalls nach ihm benannten Rydberg-Formel:
Bis zu diesem Zeitpunkt allerdings waren im Wasserstoffspektrum nur die sichtbaren Linien für bekannt, womit Rydbergs Gleichung auch eine Vorhersage noch zu findender Linien war. Die Entdeckung der im ultravioletten Bereich liegenden Lyman-Serie für durch den US-amerikanischen Physiker Theodore Lyman im Jahr 1906 sowie der im infraroten Bereich liegenden Paschen-Serie für durch den deutschen Physiker Friedrich Paschen im Jahr 1908 bestätigten jedoch schon bald die Richtigkeit von Rydbergs Erweiterung.
Ritzsches Kombinationsprinzip
Die Gleichung von Rydberg beschreibt das Wasserstoffspektrum recht genau. Bei den meisten anderen Atomen liefert sie jedoch keine korrekten Ergebnisse. Einen Fortschritt in der Beschreibung der Atomspektren lieferte im Jahr 1908 der Schweizer Mathematiker Walter Ritz. Er entdeckte das nach ihm benannte Ritzsche Kombinationsprinzip:
- Durch additive oder subtraktive Kombination, sei es der Serienformeln selbst, sei es der in sie eingehenden Konstanten, lassen sich andere Serienformeln bilden.
Vereinfacht ausgedrückt bedeutet dies, dass sich aus zwei bekannten Linien eine mögliche dritte Linie berechnen lässt. Jedoch lassen sich nicht alle dieser berechneten Linien beobachten. Welche Linien wirklich auftreten, konnte Ritz nicht erklären.
Deutung durch das Bohrsche Atommodell
Die bis zu diesem Zeitpunkt rein empirisch gefundenen Formeln ließen sich erstmals mit dem Bohrschen Atommodell verstehen. Danach sind die Spektrallinien auf den Übergang von Elektronen auf ein anderes Energieniveau zurückzuführen. Mit dem Modell von Bohr erhält man als allgemeine Gleichung für diese Übergänge:
Das erste Glied in der Klammer, , ist der so genannte Grundterm, das zweite, , wird als Laufterm bezeichnet. Hält man im Grundterm fest und variiert jeweils im Laufterm, so ergeben sich die unten aufgeführten, nach ihren Entdeckern benannten Serien. Mit Ausnahme von Hα (rot), Hβ (blaugrün), Hγ, Hδ, Hε und Hζ (alle violett) liegen sie im ultravioletten bzw. infraroten Bereich des Frequenzspektrums.
| Name | n1 | n2 | Formel | Spektralbereich/Farbe |
|---|---|---|---|---|
| Lyman-Serie | 1 | 2, 3, 4, … | Vakuum-UV (121 nm → 91 nm) | |
| Balmer-Serie | 2 | 3, 4, 5, … | rot, blaugrün, 4× violett, dann Übergang zum nahen UV → 365 nm | |
| Paschen-Serie | 3 | 4, 5, 6, … | IR-A (1875 nm → 820 nm) | |
| Brackett-Serie | 4 | 5, 6, 7, … | IR-B (4050 nm → 1460 nm) | |
| Pfund-Serie | 5 | 6, 7, 8, … | IR-B (7457 nm → 2280 nm) | |
Bereits im Bohrschen Atommodell ist, im Gegensatz zur Balmerformel, die Konstante keine rein empirische Größe. Vielmehr lässt sich der Wert direkt auf in die Rechnung eingehende Naturkonstanten zurückführen. Auch die Einschränkung auf ganzzahlige Werte für und sowie die Bedingung
folgen aus diesem Modell. Die Variablen bzw. sind danach die Hauptquantenzahlen für jenen Grund- oder angeregten Zustand, auf denen das Elektron zurückfällt, bzw. den höherenergetischen, darüber hinaus angeregten Zustand , von welchem es verfällt, d. h. ein Übergang zwischen Elektronen ist im Allgemeinen – wie bei der Balmer-Serie – auch zwischen zwei angeregten Zuständen möglich.
Die Abbildung oben rechts zeigt das Termschema des Wasserstoffatoms und visualisiert die obigen Gleichungen (in der Abbildung wird statt die Bezeichnung und statt die Bezeichnung verwendet): auf der linken vertikalen Achse ist abgetragen. Auf der rechten vertikalen Achse ist die zugehörige Anregungsenergie, jeweils vom Grundzustand aus gemessen, in eV angegeben. Der Abstand der Energieniveaus ist maßstabsgerecht. In horizontaler Richtung sind für jede Serie exemplarisch die ersten Übergänge eingezeichnet. Die zugehörigen Hauptquantenzahlen des Zustandes sind darüber angegeben. Der Abstand der Linien zueinander, d. h. in horizontaler Richtung, ist nicht maßstabsgerecht, sondern aus Gründen der Übersichtlichkeit gleich groß gewählt. Die Abbildung verdeutlicht, dass alle Linien einer Serie auf dem gleichen Energieniveau enden. Die Hα-Linie der Balmer-Serie ist somit ein Übergang von = 3 nach = 2.
Ganz rechts in den Serien ist gepunktet die jeweilige Seriengrenze dargestellt, d. h.
Das Elektron ist dann nicht mehr an dem Atomkern gebunden, das Atom ist ionisiert. Für die Lyman-Serie erhält man mit der Bohrschen Gleichung eine Energie von 13,6 eV. Auch dieser Wert stimmt mit dem experimentell bestimmten Wert für die Ionisationsenergie des Wasserstoffatoms im Grundzustand gut überein.
Die Frage, welche der Linien, die nach dem Ritzschen Kombinationsprinzip möglich sind, auch tatsächlich auftreten, wird durch die Auswahlregeln geklärt. Diese ergeben sich aus quantenmechanischen Rechnungen.
Geschichte
Der Entdecker Balmer untersuchte das von Gasentladungen in Wasserstoff ausgehende Licht, weil er vermutete, dass zwischen der Lichtemission und dem Aufbau der Atome ein ursächlicher Zusammenhang besteht. Das emittierte Licht, mit einem Gitter spektral zerlegt, zeigt die vier diskreten Linien im sichtbaren Bereich (Linienspektrum). Balmer fand 1884 das Bildungsgesetz (siehe oben) mit der Konstanten .
Er hielt seine Entdeckung für einen Spezialfall einer noch unbekannten allgemeineren Gleichung, die auch für andere Elemente gültig sein könnte. Diese Vermutung wird durch spätere Untersuchungen von Spektren von Atomen oder Ionen mit nur einem Elektron in der äußersten Schale bestätigt. Ungeklärt blieb für Balmer jedoch die physikalische Bedeutung von .
Siehe auch
Literatur
- Johann Jakob Balmer: Notiz über die Spectrallinien des Wasserstoffs. In: Wiedemann’s Annalen der Physik und Chemie 25 (1885), S. 80–87, auch zu finden als: Annalen der Physik, Band 261, Heft 5, 1885, S. 80–87 (Abgerufen am 1. November 2010)
Weblinks
Einzelnachweise
- Quelle: Helmut Vogel: Gerthsen Physik. Springer-Verlag: Berlin Heidelberg, 18. Auflage 1995, S. 623