Aliskiren
Aliskiren ist ein Arzneistoff zur Behandlung des Bluthochdrucks und der erste Vertreter aus der Gruppe der direkten Reninhemmer. Er greift in das körpereigene Renin-Angiotensin-Aldosteron-System ein, das unter anderem an der Regulierung des arteriellen Blutdrucks beteiligt ist, und ist oral wirksam.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
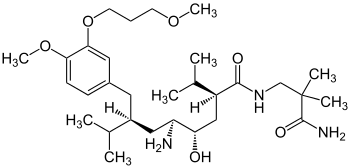 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Aliskiren | |||||||||||||||||||||
| Andere Namen |
(2S,4S,5S,7S)-5-Amino-N-(2-carbamoyl-2-methylpropyl)-4-hydroxy-2-isopropyl-7-[4-methoxy-3-(3-methoxypropoxy)benzyl]-8-methylnonanamid (IUPAC) | |||||||||||||||||||||
| Summenformel | C30H53N3O6 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 551,76 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
Wasser: > 350 g·l−1 (pH 7,4)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Aliskiren wurde im März 2007 in den USA, im Juni 2007 in der Schweiz und im August 2007 in der EU zugelassen.
Klinische Angaben
Anwendungsgebiete (Indikationen)
Aliskiren ist angezeigt zur Behandlung der essentiellen Hypertonie. Es wird dazu entweder allein oder aber in Kombination mit Diuretika eingesetzt. Die Anwendung in der Pädiatrie und bei Jugendlichen unter 18 Jahren wurde nicht untersucht, und es liegen keine wissenschaftlichen Daten vor.
Eine zusätzliche Reduktion des Blutdrucks wird durch die fixe Kombination mit dem harntreibenden Arzneistoff Hydrochlorothiazid und/oder dem Calciumkanalblocker Amlodipin erreicht.
Art und Dauer der Anwendung
Eine einmalige Einnahme pro Tag ist ausreichend. Der gewünschte antihypertensive Effekt stellt sich bei den meisten Patienten (85–90 %) nach 2 Wochen Behandlung ein. Die Resorption von Aliskiren wird durch die Einnahme fettreicher Nahrung stark vermindert.
Gegenanzeigen (Kontraindikationen)
Aliskiren ist kontraindiziert bei einer Überempfindlichkeit gegenüber dem Wirkstoff sowie während der Schwangerschaft oder Stillzeit (siehe unten).
- Aliskiren-haltige Arzneimittel sind in Kombination mit ACE Hemmern oder Angiotensin-Rezeptor-Blockern (ARB) kontraindiziert bei Patienten mit:
- Diabetes mellitus (Typ I oder II)
- Nierenfunktionsstörung (GFR < 60 ml/min/1,73 m²),
- für alle anderen Patienten wird die Anwendung von Aliskiren-haltigen Arzneimitteln in Kombination mit ACE-Hemmern oder ARB nicht empfohlen.
Anwendung während Schwangerschaft und Stillzeit
- Schwangerschaft: Aliskiren kann – wie alle Arzneistoffe, welche direkt am Renin-Angiotensin-Aldosteron-System agieren – schwerwiegende Wirkungen auf die Frucht im Mutterleib während der Fetogenese haben. Die Anwendung während der Schwangerschaft ist deshalb absolut kontraindiziert.
- Stillzeit: Es ist nicht bekannt, ob Aliskiren oder seine Stoffwechselprodukte in die Muttermilch übergehen. Aliskiren wurde allerdings während der Laktation in der Milch von Ratten gefunden. Weil die Folgen und Nebenwirkungen beim Säugling unbekannt sind, muss sich die stillende Mutter überlegen, entweder das Arzneimittel zu nehmen oder sonst abzustillen.
Unerwünschte Wirkungen (Nebenwirkungen)
Aliskiren hat bei therapeutischer Dosierung ein geringes Nebenwirkungsprofil. Die häufigste unerwünschte Wirkung war Diarrhoe (Durchfall) und andere gastrointestinale Beschwerden. Gelegentlich wurden Kopfschmerzen, Übelkeit, Müdigkeit, Infektionen der oberen Atmungsorgane, Rückenschmerzen, Husten und Hautausschläge beobachtet.
Die vorzeitig beendete (ALTITUDE-Studie)[5][6] zeigte, dass unter der zusätzlichen Gabe von 300 mg Aliskiren zur Standardtherapie mit ACE-Hemmern oder Angiotensin-II-Rezeptor Antagonisten eine erhöhte Anzahl an Patienten mit Typ-2-Diabetes „unerwünschte Ereignisse in Bezug auf nicht-tödlichen Schlaganfall, renale Komplikationen, Hyperkaliämie und Hypotonie erlitten“,[7] ohne dass der Wirkstoff einen erkennbaren Vorteil erzielt hatte.[8] Das Pharmacovigilance Risk Assessment Committee (PRAC) der europäischen Arzneimittelbehörde EMA sprach 2014 eine Empfehlung aus, nach der ACE-Hemmer, Sartane und Renin-Inhibitoren nicht miteinander kombiniert werden sollten. Bei Diabetes oder Nierenfunktionsstörungen ist demnach eine Kombination streng kontraindiziert.[9]
Eine Meta-Analyse von 2012 bezifferte den Anstieg des Hyperkaliämierisikos unter Therapie mit Aliskiren in Kombinationstherapie mit ARB oder ACE-Hemmern auf 58 %. Ein signifikantes Risiko für akutes Nierenversagen konnte nicht festgestellt werden.[10] Die Probleme die hier entstanden rührten wahrscheinlich daher, dass man nicht die harten Endpunkte beobachtet hatte (zum Beispiel Nierenversagen), sondern weiche Surrogatparameter (hier die Senkung der Kreatininwerte),[11] die aber offensichtlich nur bedingt Rückschlüsse zulassen.[12] Ein Artikel für eine Studie die die gemeinsame Anwendung dieser Stoffe ebenfalls untersuchte und mit weichen Parametern beurteilte musste zurückgezogen werden.[13]
Es stehen nur begrenzte Daten zur Überdosierung mit Aliskiren beim Menschen zur Verfügung. Der wahrscheinlichste Effekt ist eine Hypotonie (niedriger Blutdruck). Es steht kein Antidot zur Verfügung. Die Therapie besteht in der engmaschigen Überwachung der Vitalfunktionen.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Aliskiren ist ein Antihypertensivum mit einem neuartigen Wirkungsmechanismus. Es greift im Renin-Angiotensin-Aldosteron-System (RAAS) bereits ganz zu Beginn der Angiotensin-II-Biosynthese an. Aliskiren bindet direkt an die Protease Renin und verhindert dadurch die Umwandlung von Angiotensinogen in Angiotensin I. Eine wie durch die ACE-Hemmer nur unvollständig bewirkte Hemmung des Renin-Angiotensin-Aldosteron-Systems liegt hier nicht vor. Zugleich sinken auch die Angiotensin-II-Spiegel.[14]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Nach oraler Einnahme wird Aliskiren schlecht resorbiert; die orale Bioverfügbarkeit beträgt nur etwa 2,6 %. Aliskiren hat eine Plasmahalbwertszeit von 40 Stunden. Die maximale Konzentration im Blutplasma wird in ein bis vier Stunden nach oraler Einnahme erreicht. Das Verteilungsvolumen beträgt 4,2 l/kg. Der steady-state wird bei kontinuierlicher Anwendung nach ca. 7–8 Tagen erreicht. Diese Eigenschaften von Aliskiren sind auch bei älteren Patienten, Diabetikern, Patienten mit renalen und hepatischen Funktionsstörung nicht verändert.
Sonstige Informationen
Chemische und pharmazeutische Informationen
Es wird bei allen galenischen Formen Aliskiren-Hemifumarat, das Salz von Aliskiren mit Fumarsäure, verwendet. Dabei handelt es sich um ein weißes bis hellgelbes kristallines Pulver, das sehr hygroskopisch ist.[15] Es ist sehr leicht löslich in Wasser, gut löslich in Octanol und Phosphatpuffer. Der systematische Name der Verbindung lautet (2S,4S,5S,7S)-N-(2-Carbamoyl-2-methylpropyl)-5-amino-4-hydroxy-2,7-diisopropyl-8-[4-methoxy-3-(3-methoxypropoxy)phenyl]-octanamid-hemifumarat, die Summenformel ist C32H55N3O8 und die molare Masse beträgt 609,80 g·mol−1.[16]
Entwicklungsgeschichte
Die Forschung am RAAS, an Renin und den Reninhemmern hat eine mehr als dreißigjährige Geschichte. Die ersten Arzneimittel waren Peptide, welche – oral appliziert – schon im Verdauungstrakt vor ihrer Resorption zerstört wurden und eine maximale Bioverfügbarkeit von 0,5 % hatten. Das erste marktreife Präparat Pepstatin wurde bereits 1971 vorgestellt. Es hätte parenteral appliziert werden müssen, was kein Patient mit einer Hypertonie angesichts oraler Alternativen akzeptiert hätte. Außerdem waren die ersten Peptid-Reninhemmer nur sehr kurz wirksam, was wegen der mehrmals täglichen Applikation ebenfalls kein konkurrenzfähiges Medikament verhieß. Andere Präparate scheiterten an einer unzureichenden Wirkung oder Problemen mit der Verträglichkeit.[17]
Mit der Entwicklung von Aliskiren steht ein nicht-peptidischer, oral wirksamer, direkter Reninhemmer zur Behandlung der arteriellen Hypertonie (Bluthochdruck) zur Verfügung. Ciba-Geigy, heute Novartis, entwickelte Aliskiren und patentierte es 1996 unter der US-Patent-Nr. 5.559.111.[18] Die Firma Speedel, ein in Basel und Bridgewater (USA) angesiedeltes, Biopharmazie-Unternehmen, erwarb die Lizenz an SPP100 (Code-Name für Aliskiren während der Entwicklung) im Jahr 1999 von Novartis und führte in den Phasen I und II mit Erfolg 18 klinische Studien an ca. 500 Patienten sowie gesunden Probanden durch. Basierend auf den während dieses Programms generierten Ergebnissen, übte Novartis im Jahr 2002 eine ihr gewährte Rücklizenz aus und startete danach die klinischen Untersuchungen mit SPP100 in Phase III als Monotherapie gegen Bluthochdruck und in Phase IIb als Kombinationstherapie.
Im März 2007 wurde Aliskiren von der amerikanischen Arzneimittelzulassungsbehörde (FDA) als Tekturna zur oralen Behandlung der Hypertonie (Bluthochdruck) zugelassen.[19] Der Zulassungsantrag bei der Europäischen Arzneimittelagentur wurde von Novartis im Herbst 2006 eingereicht. Basierend auf Daten von über 7.800 Patienten in 44 klinischen Studien hat der Ausschuss für Humanarzneimittel (CHMP) im Juni 2007 den Antrag auf Zulassung des Reninhemmers zur Behandlung der essentiellen Hypertonie positiv bewertet, woraufhin die EU-Kommission am 22. August 2007 die Zulassung für die gesamte EU erteilte.[20] In der Schweiz wurde Aliskiren im Juni 2007 von Swissmedic zur Behandlung der essentiellen Hypertonie in der Abgabekategorie B zugelassen.[21]
Nutzenbewertung/Stellenwert
Eine über eine Senkung des Blutdruckes hinausgehende positive Wirkung von Aliskiren auf Mortalität und kardiovaskuläre Ereignisse konnte bisher nicht gezeigt werden. Daten zur Sicherheit einer Langzeitbehandlung gibt es nicht. Der therapeutische Stellenwert ist daher fraglich.[22][23] Die europäische Arzneimittelagentur rät, Patienten mit Diabetes mellitus Aliskiren nicht in Kombination mit ACE-Hemmern oder AT1-Antagonisten zu verordnen.[24]
Frühe Nutzenbewertung (§ 35a SGB V)
Eine Beschlussfassung hinsichtlich des "Zusatznutzen" von Aliskiren in der Kombination mit Amlodipin – aufgrund § 35a SGB V (AMNOG) (frühe Nutzenbewertung) – durch den Gemeinsamen Bundesausschuss (G-BA) erfolgte 2012.[25] Der Gemeinsame Bundesausschuss folgte der negativen Bewertung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).[26]
Handelsnamen
Monopräparate: Rasilez (D,[27] A, CH), Riprazo (A), Sprimeo (A), Tekturna (A, USA)
- mit Hydrochlorothiazid: Rasilez HCT (D, A, CH),[28][29][30] Tekturna HCT (USA)
- mit Amlodipin: Rasiamlo (EU)
- mit Hydrochlorothiazid und Amlodipin: Rasitrio (EU)
Weblinks
- Informationen der US-FDA: Tekturna (aliskiren) and Tekturna HCT (aliskiren/hydrochlorothiazide) Tablets (englisch)
- Informationen der Europäischen Arzneimittelagentur zu den aliskirenhaltigen Fertigarzneimitteln: European public assessment reports (englisch, teilweise deutsch)
- Pharmazeutische Zeitung online: Aliskiren, Raslilez (Novartis)
- Chemdrug.com: Synthese von Aliskiren-hemifumarat (englisch)
- www.prous.com: Molecule of the Month: Aliskirenfumarate (englisch)
Literatur
Allgemein
- Hermann J. Roth: Medizinische Chemie : Targets und Arzneistoffe. Dt. Apotheker-Verlag, Stuttgart 2005, ISBN 3-7692-3483-9.
- Heinz Lüllmann, Klaus Mohr, Lutz Hein: Pharmakologie und Toxikologie. 16. Auflage. Thieme, Stuttgart 2006, ISBN 3-13-368516-3.
- Gerhard Thews: Anatomie, Physiologie, Pathophysiologie des Menschen. Wiss. Verlag-Ges., Stuttgart 2007, ISBN 978-3-8047-2342-9.
Studien
- Juerg Nussberger, Grégoire Wuerzner, Chris Jensen, Hans R. Brunner: Angiotensin II Suppression in Humans by the Orally Active Renin Inhibitor Aliskiren (SPP100) Comparison With Enalapril. In: Hypertension. Band 39, Nr. 1, Januar 2002, S. e1–e8, doi:10.1161/hy0102.102293.
- Alberto Villamil, Steven G. Chrysant, David Calhoun, Bonnie Schober, Huang Hsu, Linda Matrisciano-Dimichino, Jack Zhang: Renin inhibition with aliskiren provides additive antihypertensive efficacy when used in combination with hydrochlorothiazide. In: Journal of Hypertension. Band 25, Nr. 1, Januar 2007, S. 217–226, doi:10.1097/HJH.0b013e3280103a6b, PMID 17143194.
- Alice Stanton, Chris Jensen, Juerg Nussberger, Eoin O'Brien: Blood Pressure Lowering in Essential Hypertension With an Oral Renin Inhibitor, Aliskiren. In: Hypertension. Band 42, Nr. 6, Dezember 2003, S. 1137–1143, doi:10.1161/01.HYP.0000101688.17370.87.
- Nancy J. Brown, Sandeep Kumar, Corrie A. Painter, Douglas E. Vaughan: ACE Inhibition Versus Angiotensin Type 1 Receptor Antagonism Differential Effects on PAI-1 Over Time. In: Hypertension. Band 40, Nr. 6, Dezember 2002, S. 859–865, doi:10.1161/01.HYP.0000040264.15961.48.
- Michel Azizi, Joël Ménard, Alvine Bissery, Than-Tam Guyenne, Alessandra Bura-Rivière, Sujata Vaidyanathan, Riccardo P. Camisasca: Pharmacologic Demonstration of the Synergistic Effects of a Combination of the Renin Inhibitor Aliskiren and the AT1 Receptor Antagonist Valsartan on the Angiotensin II–Renin Feedback Interruption. In: Journal of the American Society of Nephrology. Band 15, Nr. 12, Dezember 2004, S. 3126–3133, doi:10.1097/01.ASN.0000146686.35541.29.
- Eoin O'Brien, John Barton, Juerg Nussberger, David Mulcahy, Chris Jensen, Patrick Dicker, Alice Stanton: Aliskiren reduces blood pressure and suppresses plasma renin activity in combination with a thiazide diuretic, an angiotensin-converting enzyme inhibitor, or an angiotensin receptor blocker. In: Hypertension (Dallas, Tex.: 1979). Band 49, Nr. 2, Februar 2007, S. 276–284, doi:10.1161/01.HYP.0000253780.36691.4f, PMID 17159081.
- Victor J. Dzau: Tissue Angiotensin and Pathobiology of Vascular Disease A Unifying Hypothesis. In: Hypertension. Band 37, Nr. 4, April 2001, S. 1047–1052, doi:10.1161/01.HYP.37.4.1047.
- Felix Waldmeier, Ulrike Glaenzel, Bernard Wirz, Lukas Oberer, Dietmar Schmid, Michael Seiberling, Jessica Valencia, Gilles-Jacques Riviere, Peter End, Sujata Vaidyanathan: Absorption, Distribution, Metabolism, and Elimination of the Direct Renin Inhibitor Aliskiren in Healthy Volunteers. In: Drug Metabolism and Disposition. Band 35, Nr. 8, August 2007, S. 1418–1428, doi:10.1124/dmd.106.013797.
Einzelnachweise
- Datenblatt Aliskiren, bei Sigma-Aldrich, abgerufen am 7. Januar 2022 (PDF).
- Eintrag zu Aliskiren in der DrugBank der University of Alberta
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station, NJ 2006, ISBN 0-911910-00-X.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von (2S,4S,5S,7S)-5-Amino-N-(2-carbamoyl-2-methylpropyl)-4-hydroxy-2-isopropyl-7-[4-methoxy-3-(3-methoxypropoxy)benzyl]-8-methylnonanamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Dezember 2018.
- Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints Including 12 Month Safety Follow-up Off-treatment - Full Text View - ClinicalTrials.gov. Abgerufen am 15. Februar 2013.
- Hans-Henrik Parving, Barry M. Brenner, John J.V. McMurray, Dick de Zeeuw, Steven M. Haffner, Scott D. Solomon, Nish Chaturvedi, Frederik Persson, Akshay S. Desai, Maria Nicolaides, Alexia Richard, Zhihua Xiang, Patrick Brunel, Marc A. Pfeffer: Cardiorenal End Points in a Trial of Aliskiren for Type 2 Diabetes. In: New England Journal of Medicine. Band 367, Nr. 23, 2012, S. 2204–2213, doi:10.1056/NEJMoa1208799 (freier Volltext).
- Rote-Hand-Brief über potenzielle Risiken kardiovaskulärer oder renaler unerwünschter Ereignisse (PDF; 61 kB) abgerufen von WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- Rote-Hand-Brief zu neuen Gegenanzeigen und Warnhinweisen (PDF; 58 kB) abgerufen von WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- Doppelte RAS-Blockade schadet mehr als sie nützt. (Memento vom 15. April 2014 im Internet Archive) In: Pharmazeutische Zeitung. 11. April 2014.
- Z. Harel, C. Gilbert, R. Wald, C. Bell, J. Perl: The effect of combination treatment with aliskiren and blockers of the renin-angiotensin system on hyperkalaemia and acute kidney injury: systematic review and meta-analysis. In: BMJ. 344, 9. Jan 2012, S. e42. doi:10.1136/bmj.e42, PMID 22232539.
- Hans-Henrik Parving, Frederik Persson, Julia B. Lewis, Edmund J. Lewis, Norman K. Hollenberg: Aliskiren Combined with Losartan in Type 2 Diabetes and Nephropathy. In: New England Journal of Medicine. Band 358, Nr. 23, 2008, S. 2433–2446, doi:10.1056/NEJMoa0708379 (freier Volltext).
- Franz H. Messerli, Sripal Bangalore: ALTITUDE Trial and Dual RAS Blockade: The Alluring but Soft Science of the Surrogate End Point. In: The American Journal of Medicine. Band 126, Nr. 3, März 2013, S. e1-e3, doi:10.1016/j.amjmed.2012.07.006.
- Naoyuki Nakao, Ashio Yoshimura, Hiroyuki Morita, Masyuki Takada, Tsuguo Kayano, Terukuni Ideura: RETRACTED: Combination treatment of angiotensin-II receptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease (COOPERATE): a randomised controlled trial. In: The Lancet. Band 361, Nr. 9352, Januar 2003, S. 117–124, doi:10.1016/S0140-6736(03)12229-5.
- Alan H. Gradman, Roland E. Schmieder, Robert L. Lins, Juerg Nussberger, Yanntong Chiang, Martin P. Bedigian: Aliskiren, a Novel Orally Effective Renin Inhibitor, Provides Dose-Dependent Antihypertensive Efficacy and Placebo-Like Tolerability in Hypertensive Patients. In: Circulation. Band 111, Nr. 8, März 2005, S. 1012–1018, doi:10.1161/01.CIR.0000156466.02908.ED.
- Novartis – Tekturna® Prescribing Information (Memento vom 20. Juli 2011 im Internet Archive) (PDF; 376 kB)
- Externe Identifikatoren von bzw. Datenbank-Links zu Aliskiren-Hemifumarat: CAS-Nummer: 173334-58-2, EG-Nummer: 630-415-8, ECHA-InfoCard: 100.158.717, PubChem: 6918427, ChemSpider: 5293624, DrugBank: DB01258, Wikidata: Q27124205.
- W. Forth, D. Henschler, W. Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer, München 2005, ISBN 3-437-42521-8, S. 458.
- Patent US5559111: delta -amino- gamma -hydroxy- omega -aryl-alkanoic acid amides. Veröffentlicht am 24. September 1996, Erfinder: Richard Goeschke, Jürgen Klaus Maibaum, Walter Schilling, Stefan Stutz, Pascal Rigollier, Yasuchika Yamaguchi, Clause Nissim Cohen, Peter Herold.
- FDA Approves New Drug Treatment for High Blood Pressure.
- Europäischer Öffentlicher Beurteilungsbericht zu Rasilez® (Memento vom 30. Mai 2010 im Internet Archive)
- Zulassung von Aliskiren bei Swissmedic: Rasilez 150mg/300mg Filmtabletten (Aliskiren) (Memento vom 21. Dezember 2015 im Internet Archive).
- Michael Zieschang: Neue Entwicklungen in der Therapie des Bluthochdrucks: Renininhibitoren. (PDF; 536 kB) In: Arzneiverordnung in der Praxis. Band 34, Ausgabe 1, Januar 2007, S. 27.
- Aliskiren (Rasilez). In: KBV. Wirkstoff aktuell. 01/2008 (PDF; 70 kB).
- Questions and answers on ongoing review of aliskiren-containing medicines. (PDF) ema.europa.eu, 22. Dezember 2011, abgerufen am 7. April 2012.
- Informationsarchiv | Frühe Nutzenbewertung (§ 35a SGB V), WebSite des Gemeinsamen Bundesausschuss (G-BA).
- https://www.iqwig.de/zusatznutzen-von-aliskiren-und-amlodipin-als.1421.html (Link nicht abrufbar)
- ROTE LISTE 2017, Verlag Rote Liste Service GmbH, Frankfurt am Main, ISBN 978-3-946057-10-9, S. 159.
- Rote Liste, Stand: August 2009.
- AM-Komp. d. Schweiz, Stand: August 2009.
- AGES-PharmMed, Stand: August 2009.