Amlodipin
Amlodipin ist ein blutdrucksenkender Arzneistoff aus der Gruppe der Calciumkanalblocker (Calciumantagonisten) des Nifedipin-Typs. Es wird als Basistherapeutikum bei einem essentiellen Bluthochdruck (arterielle Hypertonie) eingesetzt. Bei der chronisch stabilen Angina Pectoris und der Prinzmetal-Angina (vasospastische Angina Pectoris) wird es außer zur Behandlung auch zur Vorbeugung gegen Anfälle verwendet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
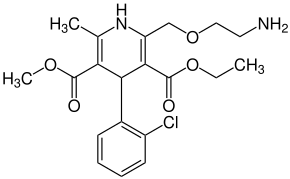 | ||||||||||||||||||||||
| Racemat: Strukturformel ohne Atropisomerie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Amlodipin | |||||||||||||||||||||
| Andere Namen |
(RS)-3-Ethyl-5-methyl-2-[(2-aminoethoxy)methyl]-4-(2-chlorphenyl)-6-methyl-1,4-dihydro-3,5-pyridindicarboxylat (IUPAC) | |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C08CA01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 408,88 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
gering in Wasser (Amlodipin·Hydrogenbenzolsulfonat)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Im Unterschied zu anderen Wirkstoffen aus dieser Gruppe hat Amlodipin eine vergleichsweise lange Plasmahalbwertszeit.
Wirkungsweise
Als Calciumkanalantagonist des Nifedipin-Typs (1,4-Dihydropyridine) blockiert Amlodipin den Calciumkanal vom L-Typ durch Bindung an die α1-Untereinheit. Der verminderte Calciumeinstrom in die glatte Muskelzelle verringert den Muskeltonus und somit primär den Gefäßwiderstand und in höheren Dosen die Kontraktilität (negativ inotrop) und den Sauerstoff-Verbrauch in den Herzmuskelzellen. Im Gegensatz zu den Calciumkanalantagonisten des Verapamil-Typs haben die Dihydropyridine eine vaskuläre Selektivität, so dass eine Herzwirkung erst bei hohen, für die Vasodilatation (Gefäßweitstellung) nicht benötigten Dosen eintritt. In der üblichen Dosierung wirkt Amlodipin vor allem auf die Koronargefäße und die peripheren Widerstandsgefäße dilatierend.[5] Amlodipin wirkt zudem als FIASMA (funktioneller Hemmer der sauren Sphingomyelinase).[6]
Pharmazeutisch verwendet wird Amlodipin als Salz der Benzolsulfonsäure (Amlodipinbesilat), der Methansulfonsäure (Amlodipinmesilat) oder der Maleinsäure (Amlodipinmaleat). Sie sind nach oraler Gabe wirksam.
Analytik
Der zuverlässige qualitative und quantitative Bestimmung von Amlodipin und seinen Metaboliten in verschiedenen Untersuchungsmaterialien gelingt nach hinreichender Probenvorbereitung durch Kopplung der Hochleistungsflüssigkeitschromatographie mit der Massenspektrometrie.[7][8][9][10]
Pharmakokinetik
Ein wichtiger Unterschied zu anderen Dihydropyridinen (z. B. Nifedipin) ist die lange terminale Halbwertszeit von etwa 35 bis 50 Stunden,[11] welche die einmal tägliche Gabe ermöglicht und durch Blutdruckschwankungen verursachten Herz-Kreislauf-Komplikationen vorbeugt.
Nebenwirkungen
Die Nebenwirkungen entsprechen denen der Wirkstoffgruppe der Calciumantagonisten. Als typische Nebenwirkung von Dihydropyridinen kann es insbesondere zu Ödemen der Beine kommen und vor allem zu Behandlungsbeginn zu Kopfschmerzen und Gesichtsrötung mit Hitzeempfindung. Weiterhin häufig sind ferner Schwindel, Müdigkeit, Palpitationen des Herzens, Bauchschmerzen und Übelkeit, gelegentlich kann Erbrechen auftreten. In sehr seltenen Fällen kann es zu allergischen Reaktionen kommen.[12] Weitere Nebenwirkung: Zahnfleisch-Wucherungen (oft bullös, aber meist entzündungsfrei). Diese verschwinden in der Regel nach einer Dosis-Reduktion oder einem Wechsel des Medikamentes wieder.
Kontraindikationen
Die Behandlung mit Amlodipin ist nicht angezeigt bei einer Überempfindlichkeit gegenüber der Substanz oder auch anderen Dihydropyridin-Derivaten, bei einem Herz-Kreislauf-Schock, bei hochgradiger Aortenstenose, instabiler Angina Pectoris oder auch bei einer schweren Leberfunktionsstörung.[13]
Handelsnamen
- Monopräparate: Norvasc (A, D), verschiedene Generika (D, A, CH)
- Kombinationspräparate:
mit Valsartan: Copalia (A), Dafiro (A, D), Exforge (A, D, CH), Imprida (A)
mit Atorvastatin: Caduet (A, CH)
mit Olmesartan: Amelior (A), Vascord (CH), Vocado (D), Sevikar (A, CH, D)
mit Ramipril: Tonotec (D)
mit Telmisartan: Twynsta (EU)
mit Bisoprolol: Bisodipin (D)
mit Lisinopril: Lisam (A)
mit Candesartan: Camlostar (D), Candam (A)
mit Perindopril: Covercard (H), BiPreterax N (D), Viacoram (D) - Tiermedizin: Amodip
Synthese
Amlodipin kann in einer zweischrittigen Reaktion hergestellt werden. Dazu reagieren in einer Mehrkomponentenreaktion die Carbonsäureester 1 und 3 mit 2-Chlorbenzaldehyd (2). In dieser Kondensationsreaktion bildet sich das Pyridin-Derivat 4 aus, welches dann unter Zugabe von Zink und Chlorwasserstoff mit einem Palladium-Katalysator den Arzneistoff Amlodipin (5) ausbildet:[14]
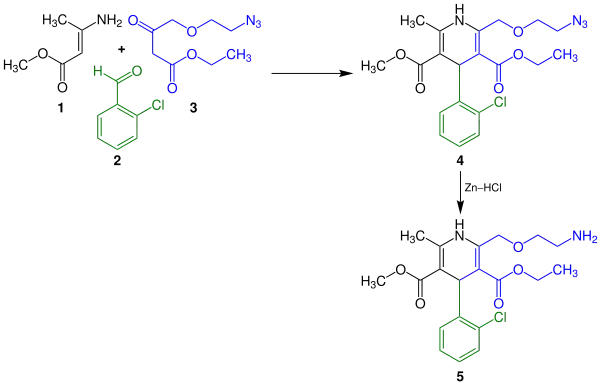
Stereoisomerie
Amlodipin wird als Racemat [1:1 Mischung aus (R)-(+)- and (S)-(–)-Amlodipin] vermarktet.[15] Eine Methode zur semi-präparativen chromatographischen Trennung der Enantiomere (S)-(–)-Amlodipin und (R)-(+)-Amlodipin ist bekannt.[16] Die Tabelle zeigt beide Stereoisomere, genauer Atropisomere. Hierbei unterscheiden sie sich in der Position des Wasserstoffatoms, welches sich entweder über oder unter der Ringebene befindet.
| Stereoisomere von Amlodipin | |
| (R)-Enantiomer | (S)-Enantiomer |
 |
 |
Einzelnachweise
- Datenblatt Amlodipine bei AlfaAesar, abgerufen am 14. Januar 2020 (PDF) (JavaScript erforderlich).
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 83.
- Eintrag zu 3-Ethyl-5-methyl-2-(2-aminoethoxymethyl)-4-(2-chlorphenyl)-1,4-dihydro-6-methyl-3,5-pyridindicarboxylat im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. März 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu 3-Ethyl-5-methyl-2-(2-aminoethoxymethyl)-4-(2-chlorphenyl)-1,4-dihydro-6-methyl-3,5-pyridindicarboxylat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Ruß; Endres: Arzneimittel pocket plus 2008. 4. Auflage. 2007, ISBN 978-3-89862-287-5.
- J. Kornhuber, M. Muehlbacher, S. Trapp, S. Pechmann, A. Friedl, M. Reichel, C. Mühle, L. Terfloth, T. Groemer, G. Spitzer, K. Liedl, E. Gulbins, P. Tripal: Identification of Novel Functional Inhibitors of Acid Sphingomyelinase. In: PLoS ONE. Band 6, Nr. 8, 2011, S. e23852, doi:10.1371/journal.pone.0023852.
- J. O. Johannsen, H. Reuter, F. Hoffmann, C. Blaich, M. H. J. Wiesen, T. Streichert, C. Müller: Reliable and easy-to-use LC-MS/MS-method for simultaneous determination of the antihypertensives metoprolol, amlodipine, canrenone and hydrochlorothiazide in patients with therapy-refractory arterial hypertension. In: J Pharm Biomed Anal. 164, 5. Nov 2018, S. 373–381. PMID 30439665
- L. Wang, W. Liu, Z. Zhang, Y. Tian: Validated LC-MS/MS method for the determination of amlodipine enantiomers in rat plasma and its application to a stereoselective pharmacokinetic study. In: J Pharm Biomed Anal. 158, 5. Sep 2018, S. 74–81. PMID 29860181
- J. V. Shah, J. M. Parekh, P. A. Shah, P. V. Shah, M. Sanyal, P. S. Shrivastav: Application of an LC-MS/MS method for the analysis of amlodipine, valsartan and hydrochlorothiazide in polypill for a bioequivalence study. In: J Pharm Anal. 7(5), Okt 2017, S. 309–316. PMID 29404054
- J. J. van der Hooft, S. Padmanabhan, K. E. Burgess, M. P. Barrett: Urinary antihypertensive drug metabolite screening using molecular networking coupled to high-resolution mass spectrometry fragmentation. In: Metabolomics. 12, 2016, S. 125. PMID 27471437
- Ernst Mutschler: Mutschler Arzneimittelwirkungen. Pharmakologie, klinische Pharmakologie, Toxikologie. 10. Auflage. Stuttgart 2013, S. 507.
- Fachinformation Norvasc, Oktober 2011.
- ABDA-Datenbank (Stand 8. Juni 2008) des DIMDI.
- Axel Kleemann, Jürgen Engel, Bernhard Kutscher, Dietmar Reichert: Pharmaceutical Substances – Syntheses, Patents and Applications of the most relevant APIs. 5. Auflage. Georg Thieme Verlag, 2009, ISBN 978-3-13-558405-8, S. 66.
- J. Lukša, D. Josič, M. Kremser, Z. Kopitar, S. Milutinovič: Pharmacokinetic behaviour of (R)-(+)- and (S)-(–)-amlodipine after single enantiomer administration. In: Journal of Chromatography B: Biomedical Sciences and Applications. 703, 1997, S. 185–193. PMID 9448075. doi:10.1016/S0378-4347(97)00394-0.
- J. Lukša, D. Josič, B. Furlan, M. Kremser: Semi-preparative chromatographic purification of the enantiomers (S)-(–)-amlodipine and (R)-(+)-amlodipine. In: Journal of Chromatography B: Biomedical Sciences and Applications. 693, 1997, S. 367–375. doi:10.1016/S0378-4347(97)00069-8.