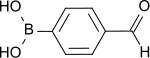
4-Formylphenylboronsäure
4-Formylphenylboronsäure (4-FPBA) ist ein vielseitiger Synthesebaustein und wichtiges Zwischenprodukt bei der Darstellung von agrochemischen und pharmazeutischen Wirkstoffen. Industrielle Anwendungen findet die Substanz als Stabilisator und Inhibitor für Enzyme[6] und als Bakterizid.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Formylphenylboronsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H8BO3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 149,94 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Über die Synthese von 4-Formylphenylboronsäure wurde 1990 aus dem Arbeitskreis von Heinrich Nöth berichtet, als Edukt wurde 4-Brombenzaldehyd benutzt.[4] Die Acetalisierung der Aldehydgruppe erfolgt nach Standardverfahren[7] mit Orthoameisensäuretriethylester und Ethanol zum 1-Brom-4-(diethoxymethyl)benzol. Die Bildung der Grignard-Verbindung mit Magnesium erfordert 1,2-Dibromethan und Aktivierung mit Ultraschall. Umsetzung mit Tri-n-butylborat führt zum geschützten Arylborsäureester, aus dem bei saurer Aufarbeitung in 78%iger Ausbeute das Zielprodukt anfällt.

Mit gleichen Reaktanden, aber durch Aktivierung mit Red-Al und Reaktion mit dem Borsäureester bei −60 °C liefert 4-FPBA in 94%iger Ausbeute, auch im Kilogrammmaßstab.[8]
Bei der Verwendung der Aryllithiumverbindung des 1-Brom-4-(diethoxymethyl)benzol mittels n-Butyllithium statt der Grignard-Verbindung bei −78 °C wird mit Triisopropylborat zur Einführung der Boronsäurefunktion 4-Formylphenylboronsäure in 99%iger Rohausbeute erhalten.[9]

Nachteilig sind bei beiden Routen der hohe Preis der eingesetzten Edukte, wie 4-Brombenzaldehyd, Borsäureester mit höheren Alkoholen und Butyllithium, sowie die schwierige Aufarbeitung nach der Hydrolyse durch n-Butanol bei der Nöth-Route.
In jüngerer Zeit wurde ein verbessertes Verfahren unter Verwendung preisgünstigerer Ausgangsstoffe wie 4-Chlorbenzaldehyd, metallisches Lithium und Trimethylborat patentiert.[10]

4-Formylphenylboronsäure kann auch durch Hydrolyse von Kalium-4-formylphenyl-trifluorborat mittels saurem Aluminiumoxid[11] oder Siliciumdioxid[12] dargestellt werden. In der Regel dienen Phenylboronsäuren als Ausgangsverbindungen für die entsprechenden Kalium-aryltrifluorborate.[13]
Eigenschaften
4-Formylphenylboronsäure kristallisiert in farblosen Nadeln[4] oder fällt als geruchloses, weißliches Pulver an, das sich wenig in kaltem, besser in heißem Wasser löst. Die Verbindung ist außerordentlich stabil[8] und bildet leicht Dimere und cyclische trimere Anhydride, die die Reinigung erschweren und zur Protodeboronierung, einer bei der Suzuki-Kupplung häufigen Nebenreaktion unter Abspaltung der Boronsäurefunktion, neigen.[14]
Anwendungen
4-Formylphenylboronsäure findet Verwendung in Suzuki-Kupplungen zum Aufbau von pharmakologisch aktiven Biphenyl-Verbindungen, wie z. B. bei einer verbesserten Synthese einer Vorstufe des blutdrucksenkenden AT1-Antagonisten Telmisartan.[15]
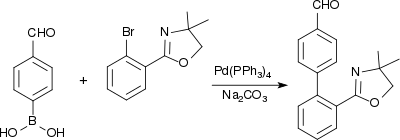
Auch palladiumkatalysierte Aryl-Heteroaryl-Verknüpfungen nach Suzuki nutzen 4-FPBA als Molekülbaustein, wie z. B. in der Synthese von Aryl-Benzimidazol-Derivaten, die an Peroxisom-Proliferator-aktivierte Rezeptoren (PPARγ) andocken und die Expression einer Vielzahl von Genen aktivieren.[16]
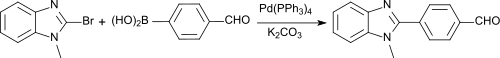
In einer Kupfer-vermittelten Fluoralkylierungsreaktion kann die Boronsäuregruppe des 4-FPBA mit perfluorierten Alkyliodiden (Rf-I) unter milden Bedingungen durch eine Perfluoralkylkette ersetzt werden.[17]
4-Formyphenylboronsäure findet in industriellem Maßstab Anwendung als Enzymstabilisator für Proteasen und insbesondere für Lipasen in flüssigen Waschmittelzubereitungen.[6] Die Zugabe von 4-FPBA in Mengen < 0,08 Gewichtsprozent in der Formulierung verringert den Verlust an hydrolytischer Aktivität der eingesetzten Enzyme und erhöht die Lagerstabilität von enzymhaltigen Flüssigwaschmitteln.[18]
Einzelnachweise
- Datenblatt 4-Formylphenylboronic acid bei Sigma-Aldrich, abgerufen am 10. Dezember 2016 (PDF).
- Datenblatt 4-Formylbenzeneboronic acid bei AlfaAesar, abgerufen am 10. Dezember 2016 (PDF) (JavaScript erforderlich).
- Eintrag zu 4-Formylphenylboronsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- H. Feulner, G. Linti, H. Nöth: Beiträge zur Chemie des Bors, 206. Darstellung und strukturelle Charakterisierung der p-Formylbenzolboronsäure. In: Chem. Ber. Band 123, Nr. 9, 1990, S. 1841–1843, doi:10.1002/cber.19901230915.
- Eintrag zu 4-formylphenylboronic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 20. Dezember 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Patent US5972873: 4-Substituted-phenyl-boronic acids as enzyme stabilizers. Angemeldet am 21. November 1997, veröffentlicht am 26. Oktober 1999, Anmelder: Novo Nordisk A/S, Erfinder: L.K. Nielsen, A. Deane-Wray.
- Autorenkollektiv, Organikum, 24. Auflage, S. 481, Wiley-VCH, Weinheim, 2001, ISBN 978-3-527-33968-6
- H. Jendralla, A. Wagner, M. Mollath, J. Wunner: Efficient, simple procedures for the large-scale preparation of buildings blocks for angiotensin (II) receptor antagonists. In: Liebigs Ann. Chem. Band 1995, Nr. 7, 1995, S. 1253–1257, doi:10.1002/jlac.1995199507166.
- Y. Kobayashi, Y. Tokoro, K. Watatani: Preparation of functionalized zinc borates and their coupling reactions with allylic acetates. In: Tetrahedron Lett. Band 39, Nr. 41, 1998, S. 7537–7540, doi:10.1016/s-0040-4039(98)01639-6.
- Patent US6833470B2: Method for producing formylphenylboronic acids. Angemeldet am 30. November 2001, veröffentlicht am 21. Dezember 2004, Anmelder: Clariant GmbH, Erfinder: A. Meudt, S. Scherer, F. Vollmüller, M. Erbes.
- G.W. Kabalka, V. Coltuclu: Thermal and microwave hydrolysis of organotrifluoroborates mediated by alumina. In: Tetrahedron Lett. Band 50, Nr. 46, 2009, S. 6271–6272, doi:10.1016/j.tetlet.2009.09.008.
- G.A. Molander, L.N. Cavalcanti, B. Canturk, P.-S. Pan, L.E. Kennedy: Efficient hydrolysis of organotrifluoroborates via silicagel and water. In: J. Org. Chem. Band 74, Nr. 19, 2009, S. 7364–7369, doi:10.1021/jo901441u.
- E. Vedejs, R.W. Chapman, S.C. Fields, S. Lin, M.R. Schimpf: Conversion of arylboronic acids into potassium aryltrifluoroborates: convenient precursors of arylboron difluoride Lewis acids. In: J. Org. Chem. Band 60, Nr. 10, 1995, S. 3020–3027, doi:10.1021/jo00115a016.
- G.K. Surya Prakash, F. Pertusati, G.A. Olah: HF-free, direct synthesis of tetrabutylammonium trifluoroborates. In: Synthesis. Band 2011, Nr. 2, 2011, S. 292–302, doi:10.1055/s-0030-1258370.
- A. S. Kumar, S. Ghosh, G.N. Mehta: Efficient and improved synthesis of Telmisartan. In: Beilstein J. Org. Chem. Band 25, 2010, S. 6, doi:10.3762/bjoc.6.25.
- G. Singh, A. Singh, V. Singh, R.K. Verma, R. Mall: Novel benzimidazole derivatives as partial PPARγ agonists: synthesis, characterization, and docking studies. In: WJPPS. Band 5, Nr. 7, 2016, S. 1080–1091, doi:10.20959/wjpps20167-7143.
- Q. Qi, Q. Shen, L. Lu: Copper-mediated aerobic fluoroalkylation of arylboronic acids with fluoroalkyl iodides at room temperature. In: J. Am. Chem. Soc. Band 134, Nr. 15, 2012, S. 6548–6551, doi:10.1021/ja301705z.
- Patent US20130252315A1: Stabilized, liquid, enzyme-containing surfactant preparation. Angemeldet am 14. Mai 2013, veröffentlicht am 26. September 2013, Anmelder: Henkel AG & Co. KGaA, Erfinder: T. O’Connell, S. Tondera, T. Weber.
