Peroxisom-Proliferator-aktivierte Rezeptoren
Peroxisom-Proliferator-aktivierte Rezeptoren (kurz: PPARs) sind intrazellulare Rezeptoren, die über einen physiologischen oder pharmakologischen Liganden aktiviert werden und als Transkriptionsfaktoren die Expression einer Vielzahl von Genen regulieren. Sie gehören zu einer Gruppe von Rezeptoren, die im Zellkern angesiedelt sind.[1][2]
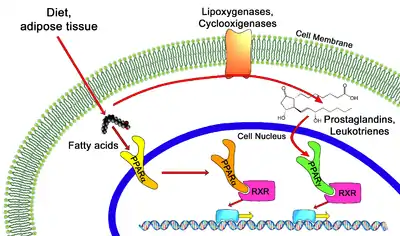
Im menschlichen Organismus konnten bisher drei PPAR-Subtypen (α, β/δ, γ) identifiziert werden. Diese unterscheiden sich nicht nur in ihrer lokalen Expression, sondern vor allem auch hinsichtlich ihres Genexpressionsmusters und der biologischen Funktion der Gene, deren Transkription durch sie beeinflusst wird.[3]
PPAR-Subtypen
PPARα
PPARα wird in hohem Maße in der Leber sowie in der Niere, dem Darm und dem Herz exprimiert. Die Aktivierung von PPARα hat in erster Linie Effekte auf die Blutfettwerte: Sie bewirkt unter anderem eine Reduktion der zirkulierenden Triglyceride, die Synthese von Apo A1, eine Steigerung der Aufnahme freier Fettsäuren, eine Erhöhung der Fettsäureoxidation und eine HDL-Erhöhung bei gleichzeitiger Reduktion der LDL-Konzentration. Darüber hinaus hat die Aktivierung von PPARα antiinflammatorische Effekte.[2][4][5][6]
PPARβ/δ
PPARβ (auch bezeichnet als PPARδ) ist in nahezu allen Geweben des menschlichen Organismus nachweisbar. Der β/δ-Rezeptor reguliert in erster Linie die Expression von Genen mit Wirkung auf den Fettstoffwechsel. Darüber hinaus besitzt PPARβ/δ zentrale Funktionen in der Zellproliferation. In Versuchen an adipösen Tieren bewirkte die Aktivierung von PPARβ/δ eine Verbesserung verschiedener metabolischer Parameter sowie eine Reduktion des Körpergewichts.[1][4][5][6]
PPARγ
PPARγ wird ubiquitär exprimiert. Die Aktivierung von PPARγ bewirkt insbesondere eine Verbesserung des Glucosestoffwechsels sowie der Insulinsensitivität. Weiterhin steigert die Aktivierung des PPARγ-Rezeptors die Aufnahme freier Fettsäuren und wirkt auf die Differenzierung von Adipozyten und Makrophagen. Darüber hinaus hat auch die Aktivierung von PPARγ antiinflammatorische Effekte. Letztlich konnte eine Assoziation zwischen der Aktivierung des PPARγ-Rezeptors und einer Reduktion des Arteriosklerose-Risikos gezeigt werden.[4][6] Amorfrutine binden und aktivieren PPARγ.[7]
Wirkmechanismus
Peroxisom-Proliferator-aktivierte Rezeptoren (PPARs) können sowohl durch physiologische als auch durch pharmakologische Liganden aktiviert werden. Nach der Aktivierung erfolgt eine Bindung der PPARs an einen ebenfalls aktivierten Retinoid-X-Rezeptor (RXR). Im Anschluss bindet dieser Komplex an eine spezifische DNA-Sequenz, das PPAR response element (PPRE), und induziert dadurch spezifische Gentranskriptionsmuster.[1]
Klinische Nutzbarkeit
Auf Grund ihres Einflusses auf verschiedene Stoffwechselprozesse im menschlichen Organismus ist das Interesse an einer therapeutischen Modulation der PPARs in den vergangenen Jahren stark angestiegen. Verschiedene Substanzen, die über eine Aktivierung der PPARs wirken, werden bereits eingesetzt oder befinden sich in klinischen Studien. Diese sogenannten PPAR-Agonisten unterscheiden sich jedoch signifikant in den durch die Aktivierung induzierten Genexpressionsprofilen, das heißt jeder PPAR-Agonist bewirkt spezifische Genaktivierungs- und Gendeaktivierungsmuster. Eine Klassifizierung der PPAR-Agonisten ist auf Grund dieses substanzspezifischen Wirkungsprofils nur äußerst eingeschränkt möglich.
Fibrate
Fibrate sind pharmakologische Liganden für PPARα, die in erster Linie als Lipidsenker zur Therapie von Fettstoffwechselstörungen zum Einsatz kommen (z. B. Bezafibrat, Gemfibrozil). Fibrate bewirken unter anderem eine ausgeprägte Reduzierung der Konzentration von Triglyceriden im Blut und einen geringen Anstieg des HDL-Cholesterins.[5][8]
Lanifibranor[9]
Das Indol-Sulfonamid ist ein pan-PPAR-Agonist, der zur Zeit (11/2021) klinisch geprüft wird. Es verbessert die Insulinsensitivität und die Aktivierung von Makrophagen. Auch vermindert es die Expression inflammatorischer Gene. Diese Wirkungen sind im Tierexperiment besser als bei einzelnen oder dualen PPAR-Agonisten.[10] In der randomisierten NATIVE-Studie wurde geprüft, ob Lanifibranor die Leberfibrosierung bei NASH (nicht alkoholische Steatose der Leber)vermindern kann. Erste Ergebnisse sind vielversprechend.[11] Ein Antrag zur "Fast-Track"-Zulassung wurde der amerikanischen Zulassungsbehörde FDA eingereicht.
Thiazolidindione/Glitazone
Thiazolidindione bzw. Glitazone sind pharmakologische Substanzen, die überwiegend PPARγ aktivieren. Sie steigern die Insulinsensitivität und verhindert eine Hyperinsulinämie. Die Thiazolidindione werden auch als Insulin-Sensitizer bezeichnet. Auf Grund ihrer Wirkung werden sie zur Behandlung von Patienten mit Diabetes mellitus eingesetzt (z. B. Pioglitazon).[5][12][13]
Glitazare
Glitazare sind duale PPAR-Agonisten, die sowohl mit dem PPARα- als auch dem PPARγ-Rezeptor interagieren und dadurch potentiell eine Vielzahl von Stoffwechselprozessen günstig beeinflussen können: Über die Aktivierung von PPARγ steigern sie die Insulinsensitivität des peripheren Gewebes. Zudem bewirkt die Aktivierung von PPARα eine Verbesserung verschiedener Parameter des Lipidprofils (z. B. Erhöhung des HDL-Cholesterins, Reduktion des LDL-Cholesterins). Aufgrund dieses dualen Wirkprinzips gelten PPARα/γ-Agonisten als vielversprechende Therapieoptionen in der kardiovaskulären Risikoprävention bei Patienten mit Typ-2-Diabetes. Allerdings konnten die ersten Vertreter der PPARα/γ-Agonisten Muraglitazar und Tesaglitazar die in sie gesetzten Erwartungen nicht erfüllen und mussten aufgrund ihres Nebenwirkungsprofils in ihrer Entwicklung gestoppt werden. Aktuell befindet sich mit Aleglitazar ein PPARα/γ-Agonist in klinischen Studien, der mit nahezu gleicher Affinität an PPARα- und PPARγ-Rezeptoren bindet. Aufgrund seiner balancierten Rezeptoraffinität bewirkt Aleglitazar ein spezifisches und für dieses Substanz charakteristisches Genaktivierungs- und Gendeaktivierungsmuster, das sich deutlich von dem anderer Glitazare unterscheidet. Klinische Daten aus Phase II belegen günstige Effekte auf den Glukosespiegel, das Lipidprofil sowie weitere kardiovaskuläre Risikofaktoren wie den Blutdruck und Entzündungsmarker. Die Daten deuten darauf hin, dass Aleglitazar das Potential besitzt, das kardiovaskuläre Risiko bei Patienten mit Typ-2-Diabetes zu senken. Diese Hypothese wird aktuell in einer Phase-III-Endpunktstudie untersucht.[4][13][14]
Einzelnachweise
- Michalik L, Auwerx J, Berger JP, et al.: International Union of Pharmacology. LXI. Peroxisome proliferator-activated receptors. In: Pharmacol Rev. 58, Nr. 4, Dezember 2006, S. 726–41. doi:10.1124/pr.58.4.5. PMID 17132851.
- Berger J, Moller DE: The mechanisms of action of PPARs. In: Annu Rev Med. 53, 2002, S. 409–35. doi:10.1146/annurev.med.53.082901.104018. PMID 11818483.
- Komar CM: Peroxisome proliferator-activated receptors (PPARs) and ovarian function--implications for regulating steroidogenesis, differentiation, and tissue remodeling. In: Reprod. Biol. Endocrinol.. 3, 2005, S. 41. doi:10.1186/1477-7827-3-41. PMID 16131403. PMC 1266036 (freier Volltext).
- Balakumar P, Rose M, Ganti SS, Krishan P, Singh M: PPAR dual agonists: are they opening Pandora's Box?. In: Pharmacol Res. 56, Nr. 2, August 2007, S. 91–8. doi:10.1016/j.phrs.2007.03.002. PMID 17428674.
- Staels B, Fruchart JC: Therapeutic roles of peroxisome proliferator-activated receptor agonists. In: Diabetes. 54, Nr. 8, August 2005, S. 2460–70. doi:10.2337/diabetes.54.8.2460. PMID 16046315.
- Tenenbaum A, Motro M, Fisman EZ: Dual and pan-peroxisome proliferator-activated receptors (PPAR) co-agonism: the bezafibrate lessons. In: Cardiovasc Diabetol. 4, 2005, S. 14. doi:10.1186/1475-2840-4-14. PMID 16168052. PMC 1236941 (freier Volltext).
- C. Weidner, J. C. de Groot, A. Prasad, A. Freiwald, C. Quedenau, M. Kliem, A. Witzke, V. Kodelja, C. T. Han, S. Giegold, M. Baumann, B. Klebl, K. Siems, L. Müller-Kuhrt, A. Schürmann, R. Schüler, A. F. Pfeiffer, F. C. Schroeder, K. Büssow, S. Sauer: Amorfrutins are potent antidiabetic dietary natural products. In: Proceedings of the National Academy of Sciences. Band 109, Nummer 19, Mai 2012, S. 7257–7262, doi:10.1073/pnas.1116971109, PMID 22509006, PMC 3358853 (freier Volltext).
- Barter PJ, Rye KA: Cardioprotective properties of fibrates: which fibrate, which patients, what mechanism? Archiviert vom Original am 5. Dezember 2010. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Circulation. 113, Nr. 12, März 2006, S. 1553–5. doi:10.1161/CIRCULATIONAHA.105.620450. PMID 16567579. Abgerufen am 12. April 2011.
- Lanifibranor. NIH, National Library of Medicine, abgerufen am 15. November 2021 (englisch).
- Sander Lefere, Tobias Puengel, Jana Hundertmark, Christian Penners, Anna Katharina Frank: Differential effects of selective- and pan-PPAR agonists on experimental steatohepatitis and hepatic macrophages☆. In: Journal of Hepatology. Band 73, Nr. 4, Oktober 2020, S. 757–770, doi:10.1016/j.jhep.2020.04.025 (elsevier.com [abgerufen am 15. November 2021]).
- Sven M. Francque, Pierre Bedossa, Vlad Ratziu, Quentin M. Anstee, Elisabetta Bugianesi: A Randomized, Controlled Trial of the Pan-PPAR Agonist Lanifibranor in NASH. In: New England Journal of Medicine. Band 385, Nr. 17, 21. Oktober 2021, ISSN 0028-4793, S. 1547–1558, doi:10.1056/NEJMoa2036205 (nejm.org [abgerufen am 15. November 2021]).
- Nissen SE, Wolski K: Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. In: N Engl J Med. 356, Nr. 24, Juni 2007, S. 2457–71. doi:10.1056/NEJMoa072761. PMID 17517853.
- Cavender MA, Lincoff AM: Therapeutic potential of aleglitazar, a new dual PPAR-α/γ agonist: implications for cardiovascular disease in patients with diabetes mellitus. In: Am J Cardiovasc Drugs. 10, Nr. 4, 2010, S. 209–16. doi:10.2165/11539500-000000000-00000. PMID 20653327.
- Henry RR, Lincoff AM, Mudaliar S, Rabbia M, Chognot C, Herz M: Effect of the dual peroxisome proliferator-activated receptor-alpha/gamma agonist aleglitazar on risk of cardiovascular disease in patients with type 2 diabetes (SYNCHRONY): a phase II, randomised, dose-ranging study. In: Lancet. 374, Nr. 9684, Juli 2009, S. 126–35. doi:10.1016/S0140-6736(09)60870-9. PMID 19515415.