Telmisartan
Telmisartan ist ein Arzneistoff aus der Gruppe der selektiven AT1-Antagonisten („Sartane“) und wird zur Behandlung des essentiellen Bluthochdrucks verwendet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
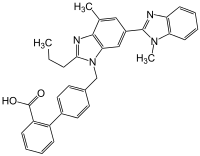 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Telmisartan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C33H30N4O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C09CA07 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 514,63 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben und Pharmakologie
Selten kann es zu Somnolenzen (eine Form der Benommenheit), Hyperkaliämie (Kaliumüberschuss), Verstopfung und einem Kreatinin-Anstieg kommen. Kontraindiziert ist die Gabe bei Patienten mit schweren Leberinsuffizienzen und im zweiten und letzten Schwangerschaftsdrittel. Vorsichtsmaßnahmen und Warnhinweise bestehen unter anderem für das erste Schwangerschaftsdrittel und für Patientinnen mit Kinderwunsch, die Anwendung bei gleichzeitigem Stillen, sowie bei eingeschränkter Nierenfunktion und leichten und mäßigen Leberfunktionsstörungen.[4]
Die Bioverfügbarkeit von Telmisartan liegt bei etwa 40 % und die Plasmahalbwertszeit bei 24 Stunden.[5] Telmisartan wird fast vollständig (zu über 99,5 %) an Plasmaproteine gebunden. Die Ausscheidung erfolgt fast ausschließlich über den Stuhl (Faeces).[4]
In der EU ist Telmisartan seit 2013 als Tierarzneimittel zur Behandlung chronischer Nierenerkrankungen mit der Folge einer Proteinurie bei Hauskatzen unter dem Markennamen Semintra zugelassen.[6][7]
Chemie
Telmisartan ist ein Derivat der Biphenyl-2-carbonsäure und enthält zwei Benzimidazol-Gruppen. Die vielstufige Synthese von Telmisartan – ausgehend von 4-Amino-3-methyl-benzoesäuremethylester – ist in der Literatur beschrieben:[8]
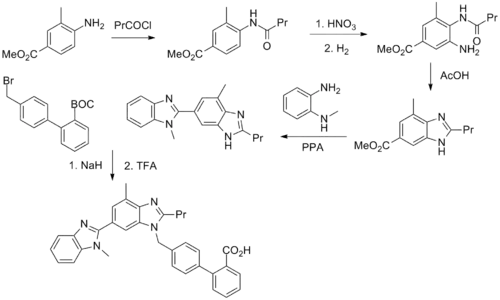
Darin steht „Pr“ für eine n-Propylgruppe.
Handelsnamen
Monopräparate: Micardis (EU, CH, USA), Kinzalmono (EU), Tolura[9]
Tiermedizin: Semintra (EU)
- mit Hydrochlorothiazid: MicardisPlus (EU, CH), Micardis HCT (USA), Kinzalkomb (EU)
- mit Amlodipin: Twynsta (EU, USA)
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Telmisartan
Einzelnachweise
- Datenblatt Telmisartan, 99% bei AlfaAesar, abgerufen am 28. April 2014 (PDF) (JavaScript erforderlich).
- Datenblatt Telmisartan, ≥98% (HPLC), solid bei Sigma-Aldrich, abgerufen am 28. April 2014 (PDF).
- Takács-Novák, K.; Urac, M.; Horváth, P.; Völgyi, G.; Anderson, B.D.; Avdeef, A.: Equilibrium solubility measurement of compounds with low dissolution rate by Higuchi's Facilitated Dissolution Method. A validation study in Eur. J. Pharm. Sci. 106 (2017) 133–144, doi:10.1016/j.ejps.2017.05.064.
- Fachinformation Micardis, Stand März 2013.
- Ernst Mutschler, Monika Schäfer-Korting: Lehrbuch der Pharmakologie und Toxikologie. 8. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart 2001. ISBN 3-8047-1763-2, S. 581.
- Committee for Medicinal Products for Veterinary Use: CVMP assessment report for Semintra (EMEA/V/C/002436) vom 13. Dezember 2012.
- Neue Behandlung für Katzen mit Chronischer Nierenerkrankung: Boehringer Ingelheim bringt Semintra® auf den Markt. (Memento des Originals vom 22. Mai 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Pressemitteilung von Boehringer Ingelheim vom 2. September 2013.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dieter Reichert: Pharmaceutical Substances, 4. Auflage (2000) 2 Bände erschienen im Thieme-Verlag Stuttgart, S. 1978–1979, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- ROTE LISTE 2013, Verlag Rote Liste Service GmbH, Frankfurt am Main, ISBN 978-3-939192-70-1.