Polyorthoester
Polyorthoester sind gekennzeichnet durch die allgemeine Struktur –[–R–O–C(R1, OR2)–O–R3–]n–, wobei der Rest R2 auch Teil eines heterocyclischen Rings mit dem Rest R sein kann. Sie entstehen durch Umesterung von Orthoestern mit Diolen oder durch Polyaddition zwischen einem Diol und einem Diketenacetal, wie z. B. 3,9-Diethyliden-2,4,8,10-tetraoxaspiro[5.5]undecan.[1]
Anwendungen
Polyorthoester finden Verwendung als hydrophobe Implantatmaterialien für Wirkstoffdepots zur kontinuierlichen Wirkstofffreisetzung durch Oberflächenerosion (englisch surface erosion).[2] Dabei soll der in einer Matrix aus Polyorthoester homogen verteilte Wirkstoff möglichst gleichmäßig über einen längeren Zeitraum in einer Freigabekinetik nullter Ordnung in den menschlichen oder tierischen Organismus abgegeben werden. Am besten als bioabbaubare Polymere für Wirkstoffimplantate charakterisiert sind vier Klassen von Polyorthoestern (POE I – IV), im Wesentlichen durch Arbeiten von Jorge Heller (1927–2009).[3]
Darstellung
1. Generation der Polyorthoester: POE I
Der Polymertyp PEO I wird durch Umesterung eines (in der Regel) α,ω-Diols mit 2,2-Diethoxytetrahydrofuran (aus γ-Butyrolacton und Orthoameisensäuretriethylester[4]) erhalten.[5]
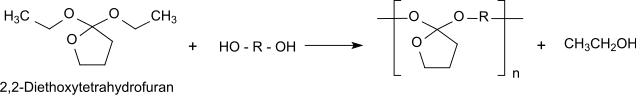
Bei Umesterungsreaktionen kommt es generell zur Abspaltung kleiner Moleküle, in diesem Fall von Ethanol, die zur Erreichung einer für die Handhabung als Implantatmaterial notwendigen Molmasse des Polymers möglichst vollständig aus dem Gleichgewicht entfernt werden müssen. Die festen POE I-Materialien sind hydrophob und besonders säureempfindlich. In wässriger Umgebung erleiden sie eine unkontrollierte, autokatalytische Hydrolyse und müssen daher durch Zugabe eines basischen pharmazeutischen Hilfsstoffes (engl. excipient) als Implantatmaterial stabilisiert werden. Beim Abbau der Polymerkette entsteht das Diol und γ-Butyrolacton, das weiter zur γ-Hydroxybuttersäure (GHB) hydrolysiert. GHB ist für die lokale Absenkung des pH-Werts beim Polymerabbau verantwortlich.
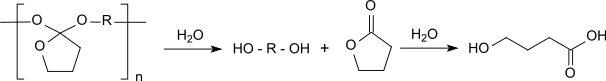
Der erforderliche Basenzusatz (z. B. Natriumcarbonat), die schwierige Synthese und die unbefriedigenden mechanischen Eigenschaften haben die Kommerzialisierung des Polyorthoestertyps POE I verhindert.
2. Generation der Polyorthoester: POE II
Der Polymertyp PEO II entsteht durch Polyaddition zwischen einem α,ω-Diol und dem Diketenacetal 3,9-Diethyliden-2,4,8,10-tetraoxaspiro[5.5]undecan (DETOSU). Die Polyreaktion verläuft wesentlich schneller als die Umesterung zu hohen Molmassen und es werden keine kleinen Moleküle wie bei dem Typ POE I abgespalten. Dazu werden die Monomeren in Tetrahydrofuran gelöst und geringe Mengen eines sauren Katalysators, z. B. p-Toluolsulfonsäure zugesetzt. Die Molmasse der Polymeren kann über die Molverhältnisse der Reaktanden gesteuert werden. Der Zusatz von Triolen führt zu vernetzten Polymeren, wobei die Vernetzungsdichte vom Verhältnis Triol/Diol bestimmt wird. Die Polyreaktion erfolgt bereits bei Raumtemperatur und Umgebungsdruck schnell und ermöglicht den Aufbau einer Polymermatrix in Gegenwart empfindlicher pharmazeutisch aktiver Wirkstoffe.
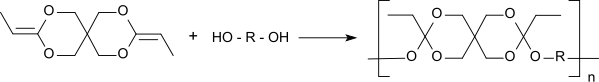
Die festen POE II-Polymeren sind sehr hydrophob, im Trockenen lagerfähig und deutlich weniger säureempfindlich als der Typ POE I. Die pH-Empfindlichkeit und damit die Abbaugeschwindigkeit in physiologischem Milieu kann ebenso wie die Glastemperatur des Polymers (und damit die mechanischen und thermischen Eigenschaften) durch Einsatz von Diolen unterschiedlicher Kettenflexibilität kontrolliert werden.[6] Die erhaltenen Polymeren des Typs POE II mit Molmassen bis über 100,000 haben daher eine glasartig-harte (z. B. bei Verwendung des starren Diols 1,4-Cyclohexandimethanol) bis halbweiche Konsistenz (bei Einsatz des flexibleren 1,6-Hexandiols).[7] Im wässrigen Milieu findet eine zweistufige nicht-autokatalytische Polymerhydrolyse statt, die zunächst neutrale Bruchstücke (Pentaerythritdipropionat und Diol) erzeugt.
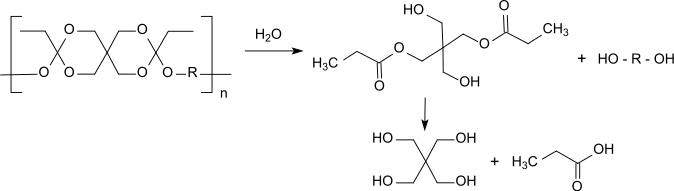
Die im zweiten Schritt erzeugte Propionsäure wird so rasch verstoffwechselt, dass es nicht zu einer lokalen Absenkung des pH-Werts führt. Deshalb müssen zur Beschleunigung des Polymerabbaus saure Zusatzstoffe, wie Suberinsäure, Adipinsäure oder Itaconsäure zugefügt werden. Mit dem Cytostatikum 5-Fluoruracil als eingelagertem Wirkstoff konnte eine Freisetzungskinetik nahezu nullter Ordnung (engl. zero-order release) realisiert werden.[8] In Toxizitätstests nach den Vorgaben des US-Arzneibuch USP erwiesen sich POE-Präparate als akut untoxisch in zellulären, intrakutanen, systemischen und intramuskulären Implantaten.[9]
3. Generation der Polyorthoester: POE III
Der Polymertyp POE III wird wie POE I durch Umesterung, in diesem Fall eines Triols, bevorzugt 1,2,6-Hexantriol, mit einem Orthoester, wie Orthoessigsäuretriethylester (Triethylorthoacetat) hergestellt.[6]
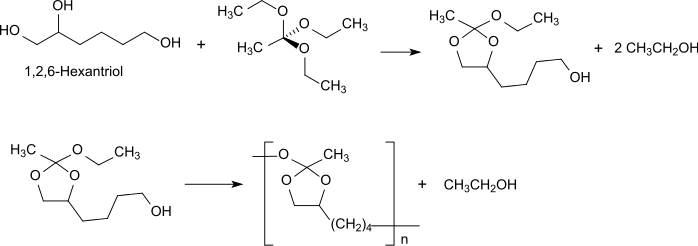
Das Triethylorthoacetat reagiert zunächst mit den vicinalen Hydroxygruppen des 1,2,6-Hexantriols zum entsprechenden cyclischen Orthoester, der durch Reaktion mit der 6-ständigen Hydroxygruppe zum Polyorthoestertyp POE III umgeestert wird. Polyorthoester des Typs POE III sind wegen des sehr flexiblen Polymerrückgrats bei Raumtemperatur halb-fest bis salbenartig und erlauben die Einarbeitung von thermolabilen und lösemittelempfindlichen Wirkstoffen bei Raumtemperatur ohne organische Lösemittel. Die erhaltenen Wirkstoffimplantate eignen sich besonders für Anwendungen am Auge, wobei keine schlagartige Wirkstofffreisetzung durch Diffusion, engl. initial burst release, sondern eine dem Polymerabbau folgende kontinuierliche Freigabe erfolgt.[10][11] Der Polymerabbau erfolgt auch bei POE III durch Spaltung der hydrolytisch labilen Bindungen im Polymerrückgrat im Sinne einer Oberflächenerosion.
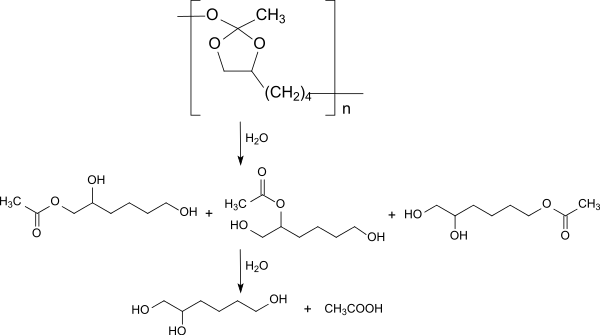
Abhängig von der initialen Bindungsspaltung am quartären Kohlenstoffatom entstehen 1-, 2- oder 6-Acetoxy-hexantriol, die weiter zu 1,2,6-Hexantriol und Essigsäure abgebaut werden. Die langwierige Synthese zum Aufbau von Polymeren mit brauchbaren Molmassen und die mangelhafte Reproduzierbarkeit schränken die Verwendung des Typs POE III für biomedizinische Anwendungen stark ein.
4. Generation der Polyorthoester: POE IV
Der Polymertyp POE IV ist eine Weiterentwicklung des Typs POE II, in dem das Diketenacetal DETOSU mit einem Diol, das kurze Sequenzen aus Polyglycolid oder Polylactid aufweist.[12][13] POE IV kann je nach Art des eingesetzten Diols als Gel (mit niedriger Glastemperatur Tg, also niedriger Molmasse) oder als Feststoff synthetisiert werden. Auch unter den sehr milden Bedingungen der Grenzflächenpolykondensation sind POE IV-Typen zugänglich.[14]
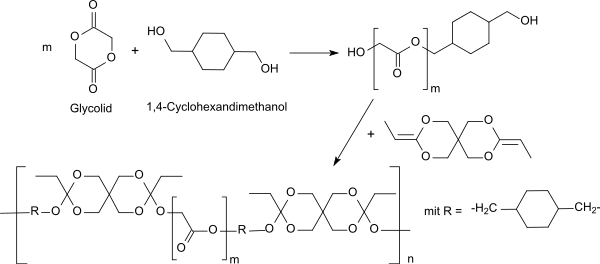
POE IV vermeidet den bei POE II erforderlichen Zusatz von sauren Exzipientien, die oft unkontrolliert aus der Polymermatrix herausdiffundieren und so zu erratischen Abbaukinetiken führen. Beim Abbau von Polyorthoestern des Typs POE IV in wässrigen Medien entsteht Glycolsäure bzw. Milchsäure, die die weitere Hydrolyse katalysieren.
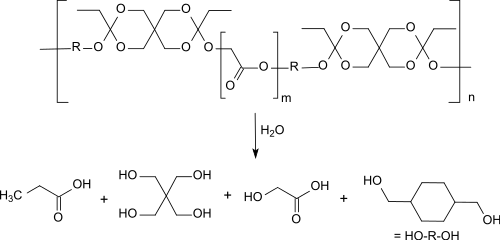
Die Abbaurate kann durch den Anteil an Glycol- bzw. Milchsäuresequenzen gesteuert werden. Implantate aus POE IV zeigen Oberflächenerosion bei hoher Biokompatibilität mit Abbauzeiten zwischen Tagen und Monaten und können somit auch als Langzeitwirkstoffdepots, z. B. für das Cytostatikum 5-Fluoruracil[15] verwendet werden.[16]
Polyorthoester des Typs POE IV werden für die aussichtsreichsten Vertreter dieser Stoffklasse als Implantatmaterialien zur kontrollierten Wirkstofffreisetzung gehalten.[1]
Literatur
- M. Chasin, R. Langer (Hrsg.): Biodegradable Polymers as Drug Delivery Systems, in Drugs and the Pharmaceutical Sciences. Band 45. Marcel Dekker, Inc., 1990, ISBN 0-8247-8344-1.
- K. E. Uhrich, S. M. Cannizzaro, R. S. Langer, K. M. Shakesheff: Polymeric Systems for Controlled Drug Release. In: Chem. Rev. Band 99, Nr. 11, 26. Oktober 1999, S. 3181–3198, doi:10.1021/cr940351u.
- J. Heller: Biopolymers I: Poly (ortho esters). In: Advances in Polymer Science. Band 107, 11. Juni 2005, S. 41–92, doi:10.1007/BFb0027551.
- Ray Smith (Hrsg.): Biodegradable Polymers for Industrial Applications. Band 45. CRC Press, 2005, ISBN 0-8493-3466-7.
- J. H. Park, M. Ye, K. Park: Biodegradable Polymers for Microencapsulation of Drugs. In: Macromolecules. Band 10, 2005, S. 146–161 (mdpi.org [PDF]).
- B. D. Ratner, A. S. Hoffman, F. J. Schoen, J. E. Lemons (Hrsg.): Biomaterials Science: An Introduction to Materials in Medicine. 3. Auflage. Academic Press, 2013, ISBN 978-0-12-374626-9.
Einzelnachweise
- N.N.: Polymers as biomaterials. (online auf: usm.edu)
- J. Heller, K.J. Himmelstein: Poly(ortho ester) biodegradable polymer systems. In: Methods Enzymol. Band 112, 1985, S. 422–436, doi:10.1016/Soo76-6879(85)12033-1.
- controlledreleasesociety.org
- Patent US4990631: Reacting trialkyl orthoformate with boron trifluoride and lactone, then with alkoxide or alkanol and base. Veröffentlicht am 5. Februar 1991, Anmelder: Alza Corp., Erfinder: K. Alster.
- J. Heller: Poly(Ortho Esters). In: A. Lendlein, A. Sisson (Hrsg.): Handbook of Biodegradable Polymers: Synthesis, Characterization and Applications. Wiley-VCH, 2011, ISBN 978-3-527-32441-5.
- Jorge Heller, John Barr, Steven Y. Ng, Khadija Schwach Abdellauoi, Robert Gurny: Polyanhydrides and Poly(ortho esters): Poly(ortho esters): synthesis, characterization, properties and uses. In: Advanced Drug Delivery Reviews. Band 54, Nr. 7, 16. Oktober 2002, S. 1015–1039, doi:10.1016/S0169-409X(02)00055-8.
- M. Bhattacharya, R. L. Reis, V. Corello, L. Boesel: 13. Material properties of biodegradable polymers. In: CRC Press. Band 16, Nr. 1–2 (Juni–Juli), 1991, S. 3–13, doi:10.1016/0168-3659(91)90026-A.
- J. Heller, Y. F. Maa, P. Wuthrich, R. Duncan: Recent developments in the synthesis and utilization of poly (ortho esters). In: J. Controlled Release. Band 16, Nr. 1–2 (Juni–Juli), 1991, S. 3–13, doi:10.1016/0168-3659(91)90026-A.
- A. U. Daniels, K. P. Andriano, W. P. Smutz, M. K. O. Chang, J. Heller: Evaluation of absorbable poly(ortho esters) for use in surgical implants. In: J. Appl. Biomaterials. Band 5, Nr. 1, 30. August 2005, S. 51–64, doi:10.1002/jab.770050108.
- S. Einmahl, M. Zignani, E. Varesio, J. Heller, J. L. Veuthey, C. Tabatabay, R. Gurny: Concomitant and controlled release of dexamethasone and 5-fluorouracil from poly(ortho ester). In: Int. J. Pharm. Band 185, Nr. 2, 20. August 1999, S. 189–198, doi:10.1016/S0378-5173(99)00149-0.
- S. Einmahl, F. Behar-Cohen, F. D’Hermies, S. Rudaz, C. Tabatabay, R. Gurny: A New Poly(Ortho Ester)-Based Drug Delivery System as an Adjunct Treatment in Filtering Surgery. In: IOVS. 42 Nummer = 3, März 2001, S. 695–700.
- S. Y. Ng, T. Vandamme, M. S. Taylor, J. Heller: Synthesis and erosion studies of self-catalyzed poly(ortho ester)s. In: Macromolecules. Band 30, Nr. 4, 24. Februar 1997, S. 770–772, doi:10.1021/ma9610626.
- J. Heller, J. Barr: Poly(ortho esters) – from concept to reality. In: Biomacromolecules. Band 5, Nr. 5, 17. August 2004, S. 1625–1632, doi:10.1021/bm040049n.
- K. Bonchemal, S. Briancon, P. Chaumont, H. Fessi, N. Zydowicz: Microencapsulation of dehydroepiandrosterone (DHEA) with poly(ortho ester) polymers by interfacial polycondensation. In: J. Microencapsulation. Band 20, Nr. 5, 2003, S. 637–651, doi:10.1080/0265204031000148040.
- S. Y. Ng, H. R. Shen, E. Lopez, Y. Zherebin, J. Barr, E. Schacht, J. Heller: Development of a poly(ortho ester) prototype with a latent acid in the polymer backbone for 5-fluorouracil delivery. In: J. Control Release. Band 65, Nr. 3, 2000, S. 367–374, doi:10.1016/S0168-3659(99)00218-7.
- J. Heller, J. Barr: Poly(ortho esters): Some recent developments, in Polymeric Drug Delivery II. In: ACS Symposium Series. Band 924, 9. März 2006, Kap. 3, S. 29–43, doi:10.1021/bk-2006-0924.ch003.