Vaginalzytologie
Die Vaginalzytologie (Synonym Kolpozytologie, von lateinisch Vagina bzw. griech. κόλπος kólpos ‚Scheide‘ sowie griech. κύτος kytos ‚Zelle‘ und λόγος lógos ‚Lehre‘) ist die mikroskopische Untersuchung von Zellen, die von der Innenauskleidung der Scheide – dem Vaginalepithel – gewonnen werden. Von ihr abzugrenzen ist der zur Tumordiagnostik eingesetzte Pap-Test, bei dem der Abstrich vom Gebärmutterhals und vom äußeren Muttermund entnommen wird. Da das Vaginalepithel im Menstruationszyklus unter dem Einfluss der Sexualhormone charakteristische Veränderungen zeigt, kann anhand des Zellbildes auf den Hormonstatus der Patientin geschlossen werden. Die Vaginalzytologie gilt als ein einfaches und kostengünstiges Verfahren zur Basisdiagnostik hormoneller Störungen in der Frauenheilkunde. Eine untergeordnete Rolle spielt die Vaginalzytologie auch in der Diagnostik von Scheidenentzündungen und Scheidentumoren.
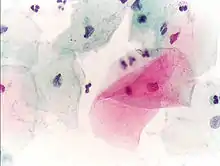
Hormonabhängige Veränderungen im Verlauf des Sexualzyklus finden bei allen Säugetieren statt. Größere praktische Bedeutung hat die Vaginalzytologie in der Tiermedizin nur bei der Hündin. Hier wird sie vor allem zur Bestimmung des optimalen Deckzeitpunktes verwendet, wobei die Kombination mit einer Scheidenuntersuchung und einer Progesteron-Bestimmung die sichersten Ergebnisse liefert.
Mikroskopisch lassen sich im Vaginalepithel vier Zelltypen unterscheiden: Basal-, Parabasal-, Intermediär- und Superfizialzellen, bei der Hündin zusätzlich „Schollen“. Unter dem Einfluss von Estrogenen kommt es zu einer Zellvermehrung mit einer Verdickung des Vaginalepithels und einem vermehrten Auftreten von Superfizialzellen (follikuläres Zellbild). Ein hoher Anteil von Intermediärzellen deutet auf hohe Progesteronwerte hin (luteales Zellbild). Findet dagegen keine nennenswerte Bildung von Geschlechtshormonen statt (normal in der Kindheit und im Alter) dominieren Basal- und Parabasalzellen (atrophisches Zellbild).
Vaginalepithel
.JPG.webp)
Die Innenauskleidung der Scheide, das Vaginalepithel, ist bei Säugetieren aus mehreren Zelllagen aufgebaut, die nicht verhornt und deren oberflächliche Zelllagen abgeflacht sind (mehrschichtiges unverhorntes Plattenepithel). Die direkt der Basalmembran anliegende Zelllage wird als Basalschicht bezeichnet, die mittleren Zelllagen als Mittel- oder Intermediärschicht und die oberflächlichen als Superfizialschicht. Dabei unterliegt das Scheidenepithel im Verlauf des Sexualzyklus typischen, sich wiederholenden Veränderungen, die vor allem auf den Einfluss der Estrogene zurückzuführen sind. Mit dem Anstieg der Estrogene vor dem Follikelsprung werden eine Zellvermehrung mit Anstieg der Zelllagen (bei der Frau auf bis zu fünfzig[1], bei der Hündin bis auf dreißig[2]) sowie eine teilweise Verhornung der Epithelzellen ausgelöst. Hormonell bedingte Umbauvorgänge finden zwar auch in anderen Abschnitten der weiblichen Geschlechtsorgane statt, aber das Scheidenepithel reagiert bereits auf viel geringere Hormonmengen als beispielsweise die Gebärmutterschleimhaut.[3]
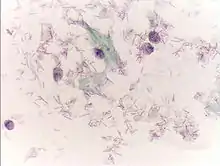
Ohne Estrogenaktivität besteht das Scheidenepithel nur aus wenigen Zelllagen und bei einem Scheidenabstrich werden entsprechend nur kleine runde Zellen gewonnen, die direkt von der Basalschicht (Basalzellen) oder den unmittelbar darüberliegenden Zellschichten (Parabasalzellen) stammen. Die Parabasalzellen bilden eine fünf- bis zehnschichtige Zelllage. Sie sind etwas größer als die Basalzellen und multipotente Zellen, die Ausgangspunkt der weiter oberflächlich gelegenen Epithelzellen sind, sich aber auch zu Histiozyten oder Drüsenzellen differenzieren können.[1] Unter Estrogeneinfluss nimmt das Verhältnis zwischen Zellkern und Zytoplasma, die Kern-Plasma-Relation, ab. Durch die Zellalterung entstehen aus den Parabasalzellen Zellen mit geschrumpften, schaumig erscheinenden Zellkernen (Intermediärzellen). Diese können anhand der Kern-Plasma-Relation in „obere“ und „tiefe“ Intermediärzellen unterschieden werden.[3] Intermediärzellen bilden reichlich Glykogen und lagern es ein. Die weitere Kernschrumpfung und die Bildung von Mucopolysacchariden sind Kennzeichen der oberflächlichen Zellen (Superfizialzellen). Die Mucopolysaccharide bilden ein keratinartiges Zellgerüst.[4] Bei Raubtieren entstehen schließlich maximal verhornte Zellen ohne Zellkern, die als Schollen bezeichnet werden.[5] Intermediär- und Superfizialzellen lösen sich ständig vom Epithel ab (Exfoliation, Abschilferung). Die in ihnen enthaltenen Zucker werden von den Bakterien der Scheidenflora zu Milchsäure vergoren und die Zellen zersetzt (Zytolyse), was unter normalen Bedingungen bei der Frau etwa eine Woche dauert.[4] Die Zytolyse findet nur bei Vorhandensein glykogenhaltiger Zellen statt, also wenn das Epithel bis zu den oberen Intermediärzellen abgebaut ist und diese abschilfern. Bei diesem Vorgang wird primär das Zytoplasma aufgelöst. Die Zellkerne bleiben, im Gegensatz zu degenerativen Prozessen, als „Nacktkerne“ erhalten.[6]
| Zelltyp | Merkmale[7][8][9] |
|---|---|
| Basalzelle |
|
| Parabasalzelle |
|
| Intermediärzelle |
|
| Superfizialzelle |
|
| Scholle | bei Hund und Katze: wie Superfizialzelle, aber ohne Zellkern |
Vaginalzytologie bei der Frau bzw. bei Mädchen
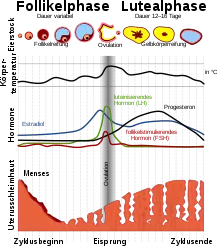
Zyklus
Die erste Monatsblutung (Menarche) tritt bei Mädchen derzeit im Mittel im Alter von etwa 13 Jahren auf.[10] In den ersten Zyklustagen wird die alte Gebärmutterschleimhaut mit der Regelblutung abgestoßen (Desquamationsphase, 1. bis 4. Zyklustag). Nach dem Ende der Blutung reifen im Eierstock neue Ovarialfollikel. Unter Einfluss der Estrogene wird die Gebärmutterschleimhaut neu aufgebaut und verdickt sich auf 10 bis 12 mm (Proliferationsphase, 5. bis 14. Zyklustag). Im Regelfall reift nur ein Follikel zum sprungreifen Graafschen Follikel und aus diesem wird beim Follikelsprung eine Eizelle freigesetzt. Der Follikelrest entwickelt sich zum Gelbkörper, welcher das schwangerschaftserhaltende Hormon Progesteron produziert. Das Progesteron bewirkt die Umwandlung in ein sekretorisches Epithel. Die Schleimhaut wird auf die Aufnahme einer befruchteten Eizelle (Nidation) vorbereitet und ihre Dicke nimmt auf 15 mm zu (Sekretionsphase, 15. bis 28. Zyklustag). Finden keine Befruchtung und Nidation statt, bildet sich der Gelbkörper zurück. Der Progesteronspiegel fällt ab dem 25. Zyklustag ab, die Durchblutung wird herabgesetzt. Die durch die Mangeldurchblutung geschädigte Schleimhaut wird abgebaut und mit der nächsten Monatsblutung abgestoßen.[11] In den Wechseljahren werden die Sexualzyklen seltener und schließlich werden sie im Mittel im 52. Lebensjahr (40–60 Jahre) ganz eingestellt (Menopause).[12]
Beurteilung
Für die Vaginalzytologie wird mit einem Wattestäbchen, Spatel oder einer feinen Bürste (Cytobrush) Zellmaterial vom oberen Drittel der seitlichen Scheidenwand entnommen (Vaginalabstrich) und anschließend fixiert und gefärbt, in der Regel mit der Papanicolaou-Färbung.[3] Alternativ kann Scheidenflüssigkeit mit isotonischer Kochsalzlösung versetzt und unter dem Phasenkontrastmikroskop beurteilt werden. Dies erspart den Färbevorgang und liefert dadurch schnelle Ergebnisse. Auch Mikroorganismen wie Candida albicans oder Trichomonas vaginalis sind gut erkennbar. Nachteilig ist, dass sich Zellkerne nur undeutlich abgrenzen und nicht weiter beurteilt werden können. Dadurch ist die Abschätzung der Kern-Plasma-Relation schwierig. Auch Tumorzellen können nicht erkannt werden, da diese vor allem durch Zellkernveränderungen identifiziert werden. Zudem ist die Befunddokumentation problematisch, da das Präparat mit dem Eintrocknen nach wenigen Minuten unbrauchbar wird.[13]
Mikroskopisch werden vier Grundzellmuster unterschieden:[14]
| Grundtyp | Zyklusphase | dominierender Zelltyp |
|---|---|---|
| Follikuläres Zellbild | Proliferationsphase | Superfizial- und Intermediärzellen |
| Luteales Zellbild | Sekretionsphase | mittelgroße („obere“) Intermediärzellen |
| Androgenes Zellbild | – | leicht gefaltete Intermediärzellen |
| Atrophisches Zellbild | Postmenopause, Kindheit | Parabasal- und Basalzellen |
Während der Regelblutung finden sich im Zellbild zahlreiche rote Blutkörperchen sowie Drüsen- und Stromazellen der Gebärmutterschleimhaut.[15]
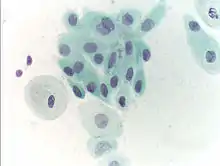
Die Vaginalzytologie ist neben dem Zervix-Score ein einfaches und kostengünstiges Untersuchungsverfahren zur ersten Einschätzung des Hormonstatus. Zur Bestimmung der Zyklusphase ist sie jedoch zu ungenau; hier werden heute zusätzlich die Blutspiegel der Hormone Estradiol, LH und Progesteron bestimmt.[16]
Ein atrophisches Zellbild bei einer Frau im gebärfähigen Alter ist ein Hinweis auf eine ungenügende Tätigkeit des Hypophysenvorderlappens oder der Eierstöcke (Ovarialinsuffizienz).[3] Bei Kindern, bei denen normalerweise ein atrophisches Zellbild vorliegt, wird die Vaginalzytologie zur Abklärung einer vorzeitigen Geschlechtsreife (Pubertas praecox) oder einer vorzeitigen Brustentwicklung (Prämature Thelarche, Infantile Makromastie) eingesetzt. Bei Jugendlichen mit ausbleibender erster Monatsblutung (Menarche) ist ein atrophisches Zellbild mit gleichzeitig hohen LH- und FSH-Werten ein Hinweis auf eine Eierstockfehlentwicklung. Ist die Menarche eingetreten, liefert die Vaginalzytologie Hinweise, ob die beteiligten Hormone im Gleichgewicht sind.[17] Daher gehört die vaginalzytologische Untersuchung zu den Minimalanforderungen vor der Verschreibung einer Antibabypille und bei den halbjährlichen Kontrolluntersuchungen.[18] Ein Androgenes Zellbild tritt auf, wenn größere Mengen männlicher Geschlechtshormone (Androgene) gebildet werden. Dies kann beispielsweise auf ein Adrenogenitales Syndrom oder einen Sertoli-Leydig-Zelltumor (Androblastom) hinweisen.[19]
Degenerative Zellveränderungen treten vor allem bei ungünstigen Umgebungsbedingungen an den abgeschilferten Zellen auf. Im Gegensatz zur physiologischen Zelllyse treten hier auch Veränderungen des Zellkerns auf. Dabei können Kernschwellung, -auflösung, -schrumpfung und -fragmentierung auftreten. Durch Anlagerung von Chromatinpartikeln an die Kernhülle färbt sich diese stärker an (Kernwandhyperchromasie). Im Zytoplasma können vermehrte Rotfärbung durch degenerative Prozesse (Pseudoeosinophilie), Hofbildung um den Zellkern, Vakuolisierung, Verdichtung mit intensiver Rotfärbung (Hyalinisation), partieller Zerfall, Auflösung (Heterolyse), Veränderung der Zellform und Reifungsstörungen auftreten.[20]
Bei akuten Entzündungen treten häufig Granulozyten auf. Bei schweren Infektionen kommt es zu einer vermehrten Abschilferung von Parabasalzellen, die Kern-Plasma-Relation verschiebt sich in Richtung Kern, im Zytoplasma können teils rot, teils blau gefärbte Areale auftreten und durch eiweißreiche Niederschläge wirkt das Hintergrundbild schmutzig.[21] Bei chronischen Entzündungen dominieren dagegen Rundzellen (Histiozyten, Lymphozyten, Plasmazellen).[22]
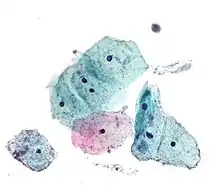
Kokkeninfektionen verursachen eine verstärkte Kernschrumpfung und Eosinophilie mit Pseudokeratinisierung. Bei einer Gardnerellen-Infektion liegen den Epithelzellen häufig staubzuckerartige Auflagerungen an.[23] Ein Scheidenpilz manifestiert sich zumeist in Pseudoeosinophilie, Zellzerfall („Masern- oder Fensterzellen“) und einem verwaschenen Hintergrund. Trichomonas vaginalis färbt sich mit den Routinefärbungen meist nur schlecht an, so dass der Erreger der Trichomoniasis mit den ähnlich großen Basalzellen verwechselt werden kann. Für dessen Nachweis ist die Phasenkontrastmikroskopie besser geeignet.[24] Herpes-simplex-Infektionen schädigen die Parabasalzellen. Hier treten Kernwandhyperchromasie, mehrere Zellkerne und Einschlusskörperchen auf.[25] Bei Humanen Papillomviren sind neben Kernwandhyperchromasie und zweikernigen Zellen auch Hohlräume im Zytoplasma („Koilozyten“) typisch.[26]
Die Vaginalzytologie eines gezielt gewonnenen Abstrichs kann auch erste Hinweise auf Frühformen eines Vaginalkarzinoms geben, der Befund wird jedoch stets durch eine Biopsie mit pathohistologischer Untersuchung gesichert.[27] Zur Diagnostik des viel häufigeren Gebärmutterhalskrebses oder von Gebärmuttertumoren wird heute direkt ein Gebärmutterhalsabstrich entnommen und mittels Pap-Test untersucht.[28]
Strahlenexposition, Folsäuremangel und verschiedene bei der Chemotherapie eingesetzte Zytostatika können ebenfalls zu Veränderungen des Zellbildes führen.[29]
Zellindizes
Zur Einschätzung der hormonellen Aktivitäten lassen sich einige Kennzahlen (Indizes) ermitteln. Sie haben jedoch mit der Möglichkeit genauer Hormonbestimmungen an praktischer Bedeutung verloren, da sie lediglich das Verhältnis der Sexualhormone zueinander reflektieren.[30] Der Karyopyknose-Index gibt den Anteil der Zellen mit geschrumpftem Zellkern, der Eosinophilie-Index den Anteil rot angefärbter Superfizialzellen und der Faltungsindex den Anteil gefalteter Superfizial- und Intermediärzellen an. Der Eosinophilie-Index erreicht mit 50 % sein Maximum in der Zyklusmitte und sein Minimum mit 20 % zu Zyklusbeginn. Der Karyopyknose-Index folgt dem Eosinophilie-Index, seine Werte liegen 10 Prozentpunkte höher. Diese Indizes reflektieren die Estradiol-Konzentration im Blutplasma, wobei die Index-Maxima etwa ein bis zwei Tage hinter dem maximalen Hormonspiegel auftreten.[15]
Hormonelle Verhütungsmittel (Antibabypille) beeinflussen unter Umständen das Zellbild und die Zellindizes. Bei den Sequenzpräparaten wird der normale hormonale Zyklus imitiert, die Zellindizes zeigen zwar einen normalen Zyklusverlauf, liegen aber etwas niedriger als ohne Antibabypille. Die Kombinationspräparate verursachen einen konstanten Hormonspiegel und damit konstante Indizes von 20 bis 30 %. Die östrogenfreie „Minipille“ lässt das Zellbild weitgehend ungestört. Bei der Hormonersatztherapie in der Postmenopause liegen die Indizes konstant zwischen 20 und 30 %.[30]
Proliferationsscore
Die Reifegrade der Vaginalepithelzellen können mit Ziffern kodiert werden. Bei der klassischen Einteilung nach Schmitt werden Parabasalzellen mit 1, kleine Intermediärzellen mit 2, große Intermediärzellen mit 3 und Superfizialzellen mit 4 bezeichnet. Bei gemischten Zellbildern wird nach grober Schätzung die häufigste und die zweithäufigste Zellpopulation bestimmt. Ein Proliferationsscore Grad 1 bedeutet, dass ausschließlich Parabasalzellen vorkommen, der Grad 4-3 besagt, dass vor allem Superfizialzellen und darüber hinaus einige große Intermediärzellen vorhanden sind.[31][32]
Nachteilig an dieser Einteilung ist, dass die Abgrenzung großer von kleinen Intermediärzellen nicht ganz eindeutig ist sowie dass weder Basalzellen noch die Baso- bzw. Eosinophilie von Superfizialzellen berücksichtigt werden. Die modifizierte Einteilung nach Schmitt trägt diesen Unzulänglichkeiten Rechnung. Hier werden Basalzellen mit 0, Parabasalzellen mit 1, Intermediärzellen mit 2, basophile Superfizialzellen mit 3 und eosinophile Superfizialzellen mit 4 kodiert. Die Bestimmung des Proliferationsscore ist eine preiswerte und schnelle Methode, die ungefähren Sexualhormonspiegel abzuschätzen, weshalb sie heute immer noch in der Routinediagnostik angewendet wird.[31]
Eine hohe Proliferation (Score 4 oder 3) ist bei geschlechtsreifen Frauen normal, aber auch bei Säuglingen in der ersten Lebenswoche, weil bei letzteren noch die Sexualhormonspiegel aus der Zeit im Mutterleib nachwirken. In der normalen Schwangerschaft verhindern die hohen Progesteronspiegel trotz hoher Estrogenwerte eine vollständige Ausreifung der Epithelzellen; bei einer gestörten Schwangerschaft fällt dagegen der Progesteronspiegel, weshalb ein hoher Proliferationsscore auftreten kann.[31]
Eine niedrige Proliferation (Score 0 oder 1) ist bei sehr niedrigen Sexualhormonspiegeln anzutreffen, beispielsweise in der Kindheit und nach den Wechseljahren, aber auch bei abgestorbener Frucht im Mutterleib, nach einer Eierstockentfernung und in der Stillzeit nach einer Geburt. Eine niedrige Proliferation kann auch unter der „Minipille“ oder bei Entzündungen auftreten.[31]
Eine mittlere Proliferation (Score 2) ist bei Einnahme von Steroidhormonpräparaten typisch. Auch andere Wirkstoffe wie Histamin und Herzglykoside können eine mittlere Proliferation auslösen.[33]
Eine gemischte Proliferation mit wechselnden Werten tritt bei 10 % aller Frauen nach den Wechseljahren auf, weil in der Nebennierenrinde und im Fettgewebe Sexualhormone gebildet werden.[31]
Vaginalzytologie bei der Hündin
Zyklus
Die Geschlechtsreife tritt bei Hunden im Alter von sechs Monaten bis zwei Jahren ein. Hunde haben im Regelfall zwei Läufigkeiten pro Jahr und dazwischen eine Phase hormoneller Inaktivität (Anöstrus). Die Läufigkeit beginnt mit einer Vorbrunst (Proöstrus), in der Follikel heranreifen und große Mengen Estrogene produzieren. Die Estrogene bewirken auch einen Durchtritt roter Blutkörperchen durch die Vaginalschleimhaut. Zwei bis drei Tage vor den Follikelsprüngen (Ovulationen) kommt es zu einer maximalen Ausschüttung des Luteinisierenden Hormons, welches wiederum einen Anstieg des Progesterons und des Abfall der Estrogene zur Folge hat. Die eigentliche Phase der Deckbereitschaft („Standhitze“) beträgt nur wenige Tage. In der Nachbrunst (Metöstrus) wird das im Scheidenlumen verbliebene Sekret und Zellmaterial durch weiße Blutkörperchen („neutrophile Abräumphase“) abgebaut. Ein den Wechseljahren der Frau entsprechendes Phänomen gibt es bei Hunden nicht, die Anzahl der Läufigkeiten pro Jahr nimmt zwar im hohen Alter meist ab, aber es kommt nicht zur vollständigen Einstellung der Sexualzyklen.[34]
Beurteilung
Die Entnahme der Probe erfolgt mit einem angefeuchteten Wattestäbchen vorzugsweise vom Scheidendach. Ist keine bakteriologische Untersuchung geplant, kann die Probe auch aus dem Scheidenvorhof genommen werden, da hier die gleichen Zellveränderungen auftreten.[35] Allerdings können die hier physiologisch stets vorhandenen verhornten Superfizialzellen die Beurteilung erschweren.[36] Anschließend wird das Stäbchen auf einem Objektträger abgerollt, die Probe luftgetrocknet und mit einem Schnellfärbeset gefärbt. In der Tiermedizin sind vor allem Schnellfärbungen vom Romanowsky-Typ üblich. Papanicolaou- oder Trichrom-Färbungen sind zur Beurteilung von Keratinvorstufen zwar besser geeignet, setzen aber eine umfangreichere Ausstattung voraus und sind zeit- und kostenintensiver. Statt der Entnahme mit einem Wattestäbchen kann auch mit einer Pipette sterile isotonischen Kochsalzlösung in die hintere Scheide eingebracht und wieder angesaugt werden (Spülprobe).[9] Jede Phase des Brunstzyklus hat andere dominierende Zelltypen, wobei die Übergänge stets fließend sind:
| Zyklusphase | Dauer | Merkmale |
|---|---|---|
| Proöstrus | 9 (1–27) Tage | Erythrozyten, Intermediär- und Superfizialzellen
zu Beginn auch Parabasalzellen, im Verlauf Zunahme der Superfizialzellen und Abnahme der Erythrozyten[37] |
| Östrus | 8 (4–24) Tage | Superfizialzellen und Schollen (> 80 %), kaum noch Erythrozyten[38]
gegen Ende Schollen zu „Nestern“ zusammengelagert[5] |
| Metöstrus | 60–80 Tage | Intermediär- und Parabasalzellen stetig zunehmend
zu Beginn auch neutrophile Granulozyten[39] |
| Anöstrus | wenige Wochen bis mehrere Monate | zellarm, vor allem Parabasal-, einige Basalzellen[40] |
Bei Hündinnen vor der Geschlechtsreife gleicht das Zellbild dem im Anöstrus.[9]
Die Vaginalzytologie wird in der Tiermedizin vor allem zur Bestimmung des Deckzeitpunktes eingesetzt. Die fruchtbare Phase einer Hündin liegt etwa zwischen vier Tage vor bis vier Tage nach den Follikelsprüngen, optimal sind die vier Tage nach den Ovulationen. Vor allem bei künstlicher Besamung oder wenn der Deckrüde weit entfernt wohnt, ist eine präzise Bestimmung des Zeitpunkts der Ovulationen meist unabdingbar. Die Vaginalzytologie allein führt nur in zwei Dritteln der Fälle zu einer optimalen Belegung. Da die maximale Verhornung vier Tage vor bis einen Tag nach den Follikelsprüngen auftreten kann, ist die Vorhersagegenauigkeit eingeschränkt.[41] Die ein- bis zweitägige Bestimmung des Progesteron-Spiegels bietet eine genauere Vorhersage, ist aber meist nur in externen Labors möglich, so dass die Ergebnisse erst mit Zeitverzögerung zur Verfügung stehen. Am besten ist die Kombination aus Kolposkopie, Vaginalzytologie und Progesteronbestimmung.[42] Alternativ kann man die Hündin über die gesamte zytologische Östrusphase alle zwei bis drei Tage decken lassen.[41]
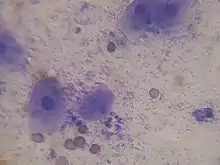 Hündin, früher Proöstrus: Intermediärzellen und rote Blutkörperchen, schmutziger Hintergrund
Hündin, früher Proöstrus: Intermediärzellen und rote Blutkörperchen, schmutziger Hintergrund Hündin, später Östrus: kernlose Schollen zu Nestern zusammengelagert
Hündin, später Östrus: kernlose Schollen zu Nestern zusammengelagert
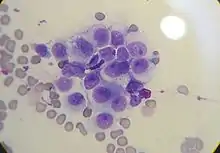
Weitere Indikationen für eine Vaginalzytologie sind mangelnde Deckbereitschaft[43] und ausbleibende Läufigkeit nach mindestens einer Läufigkeit.[44] Bei Ovarialzysten und Granulosazelltumoren liegt ein Zellbild wie in der Läufigkeit vor. Bei einer Scheidenentzündung oder einer Gebärmuttervereiterung sind reichlich Bakterien und weiße Blutkörperchen vorhanden, bei einer bakteriellen Scheidenentzündung findet man häufig degenerierte Granulozyten und phagozytierte Bakterien.[45] Bakterien können aber auch bei gesunden Tieren im Proöstrus oder Puerperium vorkommen, gelegentlich auch im Östrus oder Metöstrus. Zumeist korreliert der mikroskopische Nachweis von Bakterien im Rahmen der Vaginalzytologie nicht mit den Ergebnissen einer bakteriologischen Untersuchung, für welche die Probenentnahme aus dem Scheidengewölbe erfolgen sollte.[46]
Darüber hinaus eignet sich die Vaginalzytologie zur Diagnostik eines Sticker-Sarkoms. Hierbei lassen sich vakuolisierte Rundzellen mit zahlreichen Mitosen nachweisen.[47] Die Zellkerne liegen meist etwas exzentrisch, zeigen eine unterschiedliche Größe (Anisokaryose) und eine grobe Chromatinstruktur.[48] Andere Vaginaltumoren sind bei der Hündin in der Regel gutartig und mesenchymaler Herkunft (Leiomyome, Fibrome, Fibropapillome). Typisch für diese Tumoren sind Gruppen spindelförmiger Zellen mit ovalem Zellkern.[49] Schließlich kann eine Vaginalzytologie bei einer Zuckerkrankheit abgebracht sein, um bei einer intakten Hündin einen Typ-3-Diabetes infolge hoher Progesteron-Werte auszuschließen.[50]
Vaginalzytologie bei anderen Tierarten
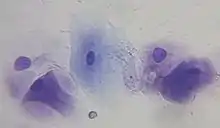
Eine gewisse Bedeutung hat die Vaginalzytologie zur Bestimmung der Zyklusphasen bei der Zucht von Labortieren wie Mäusen und Ratten. Zu diesem Zweck werden auch die Beurteilung der äußeren Geschlechtsorgane, Messungen der elektrischen Impedanz oder die biochemische Analyse des Urins eingesetzt, allerdings liefert die Vaginalzytologie die zuverlässigsten Ergebnisse für alle Zyklusphasen.[51] Die Vorhersagegenauigkeit des Östrus bei Mäusen beträgt aber nur 46 %, so dass die Kombination mit einer histologischen Untersuchung der Vaginalfalten sinnvoll ist.[52]
Bei Hauskatzen ist eine Zyklusbestimmung mit ausreichender Genauigkeit möglich. Da Katzen durch den Deckakt ausgelöste Follikelsprünge zeigen (→ Rolligkeit), kann bereits die mechanische Reizung der Scheide bei der Probenentnahme zu Ovulationen führen. Die Zellbilder bei der Katze ähneln denen bei der Hündin, rote Blutkörperchen und Granulozyten treten aber im Regelfall nicht auf. Der Anteil von Superfizialzellen im Östrus ist geringer als bei der Hündin (40 bis 88 %), Schollen machen etwa 10 % der Zellen am Tag der Ovulationen und bis zu 40 % am darauffolgenden Tag aus. Typisch ist ebenfalls, dass am Tag der Follikelsprünge der Hintergrund deutlich aufklart.[45] Am Ende des Östrus dominieren Schollen, Zellnester treten bei der Katze aber nicht auf. Eine halbwegs verlässliche Vorhersage des Eisprungs ist anhand der Vaginalzytologie bei Katzen nicht möglich.[53]
Geschichte
Wegbereitend für die Entwicklung der modernen Zytologie war die Arbeit von Johannes Müller. Er gilt als der Erste, der Tumorzellen nachweisen konnte. 1838 veröffentlichte er das damals wegweisende Werk Über den feineren Bau und die Formen der krankhaften Geschwülste.[54] Die erste Untersuchung zu den Zellveränderungen im Verlauf des Menstruationszyklus wurde 1847 von Félix Archimède Pouchet veröffentlicht. Der griechischstämmige Arzt George Nicolas Papanicolaou begann Anfang des zwanzigsten Jahrhunderts mit systematischen Untersuchungen zu den vaginalzytologischen Veränderungen bei Mensch und Tier, er entwickelte auch die alkoholische Fixierung der Proben und neue Färbeverfahren. 1928 veröffentlichte er seine Ergebnisse zur Zytodiagnostik. Im gleichen Jahr publizierte, unabhängig von Papanicolaou, auch der rumänische Pathologe Victor Babeș eine vaginaltumorzytologische Studie.[55] Beide Arbeiten fanden aber zunächst wenig Beachtung, so dass sich Papanicolaou wieder der hormonellen Vaginalzytologie zuwandte. 1933 veröffentlichte er seine Ergebnisse unter dem Titel The sexual cycle in the human female as revealed by vaginal smears im American Journal of Anatomy.[56] Ende der 1920er und Anfang der 1930er Jahre entdeckten Adolf Butenandt und unabhängig von ihm auch andere Arbeitsgruppen die verschiedenen Sexualhormone[57], welche diese Zellveränderungen bedingen.
Die 1943 von Papanicolaou und dem Gynäkologen Herbert F. Traut veröffentlichte Monografie Diagnosis of uterine cancer by the vaginal smear gilt als Geburtsstunde der gynäkologischen Zytodiagnostik.[55] 1948 fassten Papanicolaou, Traut und Andrew Anthony Marchetti ihre Erkenntnisse zur Vaginalzytologie in dem Werk The epithelia of woman’s reproductive organs zusammen.[56] 1953 publizierte A. Schmitt die noch heute übliche Gradeinteilung zur Charakterisierung der Proliferation des Vaginalepithels.[58] 1957 wurde die Internationale Akademie für Zytologie in Brüssel gegründet. Ihr erster Vorsitzender wurde der deutsche Gynäkologe Hans-Klaus Zinser, der 1949 die Phasenkontrastzytologie eingeführt hatte.[55]
Literatur
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7.
- Gerd Neumann, Axel Schäfer und Werner Mendling: Phasenkontrast-Mikroskopie in der Frauenarztpraxis. Springer, Berlin, Heidelberg 2014, ISBN 978-3-642-38309-0.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 36–47.
- Laia Solano-Gallego: Vagina. In: Rose E. Raskin und Denny J. Meyer (Hrsg.): Canine and feline cytology. 2. Auflage. Saunders, St. Louis 2010, ISBN 978-1-4160-4985-2, S. 288–294.
Einzelnachweise
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 22.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 37.
- Karl Knörr, Henriette Knörr-Gärtner, Fritz K. Beller, Christian Lauritzen: Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. 3. Auflage. Springer, Berlin 2013, ISBN 978-3-642-95584-6, S. 24–25.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 23.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 17.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 64–65.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 24–29.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 39.
- Laia Solano-Gallego: Vagina. In: Rose E. Raskin und Denny J. Meyer (Hrsg.): Canine and feline cytology. 2. Auflage. Saunders, St. Louis 2010, ISBN 978-1-4160-4985-2, S. 289.
- Freimut Leidenberger, Thomas Strowitzki und Olaf Ortmann: Klinische Endokrinologie für Frauenärzte. 4. Auflage. Springer, Heidelberg 2009, ISBN 978-3-540-89759-0, S. 81.
- Jan Behrends, Josef Bischofberger, Rainer Deutzmann: Physiologie. 2. Auflage. Georg Thieme, Stuttgart 2012, ISBN 978-3-13-138412-6, S. 425.
- Freimut Leidenberger, Thomas Strowitzki und Olaf Ortmann: Klinische Endokrinologie für Frauenärzte. 4. Auflage. Springer, Heidelberg 2009, ISBN 978-3-540-89759-0, S. 203.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 36.
- Manfred Kaufmann, Serban-Dan Costa, Anton Scharl: Die Gynäkologie. 3. Auflage. Springer, Berlin, Heidelberg 2012, ISBN 978-3-642-20922-2, S. 171–172.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 32.
- Kai J. Bühling und Wolfgang Friedmann: Intensivkurs Gynäkologie und Geburtshilfe. Elsevier, Urban&Fischer, München 2009, ISBN 978-3-437-42401-4, S. 30.
- Alfred S. Wolf: Kinder- und Jugendgynäkologie: Atlas und Leitfaden für die Praxis. 2. Auflage. Schattauer, Stuttgart 2002, ISBN 978-3-7945-2125-8, S. 21–22.
- Karl Knörr, Henriette Knörr-Gärtner, Fritz K. Beller, Christian Lauritzen: Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. 3. Auflage. Springer, Berlin 1989, ISBN 978-3-642-95584-6, S. 80.
- Theodor Hellbrügge: Pädiatrische Diagnostik. Pädiatrische Therapie. Band 2. Springer, Berlin 1966, ISBN 978-3-642-94950-0, S. 621.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 66–67.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 114.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 120.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 95.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 101.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 107.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 109.
- Karl Knörr, Henriette Knörr-Gärtner, Fritz K. Beller, Christian Lauritzen: Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. 3. Auflage. Springer, Berlin 1989, ISBN 978-3-642-95584-6, S. 670.
- Joachim Dudenhausen, Hermann P. G. Schneider, Gunther Bastert: Frauenheilkunde und Geburtshilfe. 2. Auflage. De Gruyter, Berlin 2003, ISBN 3-11-016562-7, S. 327.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 89.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 33.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 34.
- Gerd Neumann, Axel Schäfer und Werner Mendling: Phasenkontrast-Mikroskopie in der Frauenarztpraxis. Springer, Berlin, Heidelberg 2014, ISBN 978-3-642-38309-0, S. 87.
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 35.
- Peter F. Suter und Barbara Kohn: Praktikum der Hundeklinik. 10. Auflage. Paul Parey, Stuttgart 2004, ISBN 978-3-8304-4141-0, S. 859–860.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 41.
- Laia Solano-Gallego: Vagina. In: Rose E. Raskin und Denny J. Meyer (Hrsg.): Canine and feline cytology. 2. Auflage. Saunders, St. Louis 2010, ISBN 978-1-4160-4985-2, S. 288.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 16.
- Laia Solano-Gallego: Vagina. In: Rose E. Raskin und Denny J. Meyer (Hrsg.): Canine and feline cytology. 2. Auflage. Saunders, St. Louis 2010, ISBN 978-1-4160-4985-2, S. 290.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 18.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 19.
- Laia Solano-Gallego: Vagina. In: Rose E. Raskin und Denny J. Meyer (Hrsg.): Canine and feline cytology. 2. Auflage. Saunders, St. Louis 2010, ISBN 978-1-4160-4985-2, S. 291.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 154–156.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 88.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 79.
- Laia Solano-Gallego: Vagina. In: Rose E. Raskin und Denny J. Meyer (Hrsg.): Canine and feline cytology. 2. Auflage. Saunders, St. Louis 2010, ISBN 978-1-4160-4985-2, S. 292.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 38.
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 144.
- Laia Solano-Gallego: Zytologisches Praktikum für die Veterinärmedizin. Hrsg.: Reinhard Mischke. Schlütersche, Hannover 2005, ISBN 3-89993-013-4, S. 136.
- Laia Solano-Gallego: Vagina. In: Rose E. Raskin und Denny J. Meyer (Hrsg.): Canine and feline cytology. 2. Auflage. Saunders, St. Louis 2010, ISBN 978-1-4160-4985-2, S. 293.
- Astrid Wehner und Sylvia Geist: Update zur Insulintherapie bei Hund und Katze. In: Kleintierpraxis. Band 59, Nr. 8, 2015, S. 443–462, doi:10.2377/0023-2076-59-443.
- S. L. Byers et al.: Mouse estrous cycle identification tool and images. In: PloS one. Band 7, Nr. 4, 2012, ISSN 1932-6203, S. e35538, doi:10.1371/journal.pone.0035538, PMID 22514749, PMC 3325956 (freier Volltext).
- A. Galet al.: Vaginal fold histology reduces the variability introduced by vaginal exfoliative cytology in the classification of mouse estrous cycle stages. In: Toxicologic pathology. Band 42, Nr. 8, 2014, ISSN 1533-1601, S. 1212–1220, doi:10.1177/0192623314526321, PMID 24705880.
- Theresa Conze und Axel Wehrend: Zyklus und Zyklusbestimmung bei der Katze. In: Kleintiermedizin Nr. 4, 2015, S. 178–183.
- Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil und Wolfgang Wegner: Enzyklopädie Medizingeschichte. Band 1. Walter de Gruyter, Berlin, New York 2007, ISBN 978-3-11-019703-7, S. 1537 (hier online).
- Hans Friedrich Nauth: Gynäkologische Zytodiagnostik. 2. Auflage. Georg Thieme, Stuttgart 2014, ISBN 978-3-13-131092-7, S. 16–17.
- Aristidis Diamantis, Emmanouil Magiorkinis und Helen Koutselini: 50 years after the death of George Nicholas Papanicolaou (1883–1962): Evaluation of his scientific work. In: Acta med-hist Adriat. Band 12, Nr. 3, 2014, ISSN 1334-4366, S. 181–188.
- J. R. Tata: One hundred years of hormones. In: EMBO reports. Band 6, Nr. 6, 2005, ISSN 1469-221X, S. 490–496, doi:10.1038/sj.embor.7400444, PMID 15940278, PMC 1369102 (freier Volltext).
- A. Schmitt: Eine Gradeinteilung für die funktionelle Zytodiagnostik in der Gynäkologie. In: Geburtshilfe und Frauenheilkunde. Band 13, 1953, ISSN 1431-4878, S. 593–603.