Tripropylamin
Tripropylamin (nach IUPAC-Nomenklatur: N,N-Dipropylpropan-1-amin, auch Tri-n-propylamin) ist eine organisch-chemische Verbindung aus der Stoffgruppe der tertiären aliphatischen Amine.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
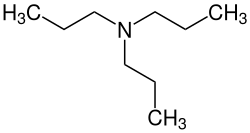 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tripropylamin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C9H21N | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit aminartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 143,27 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,75 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
156 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,4181 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Die großtechnische Herstellung von Tripropylamin erfolgt nach einem zweistufigen Prozess. Zunächst wird n-Propanol mit Ammoniak in der Gasphase an einem kupfer- oder nickelhaltigen Heterogenkatalysator bei Temperaturen von 130 bis 250 °C und Drücken im Allgemeinen von 1 bis 220 bar zu einem Produktgemisch aus Mono-, Di- und Tripropylamin umgesetzt.[3]
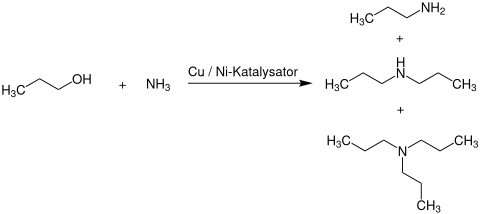
Im nächsten Schritt wird dieses durch mehrstufige Destillation aufgetrennt und das bereits entstandene Tri-n-propylamin entnommen. Das verbleibende Di-n-propylamin wird dann in einem zweiten Reaktor, an einem mit Aluminium- und Zirconium(IV)-oxid geträgerten Kupfer- oder Nickelkatalysator, bei Temperaturen von 200 bis 260 °C und Drücken von 60 bis 150 bar zu Tri-n-propylamin und Ammoniak umgesetzt. Nicht umgesetztes n-Propanol, Ammoniak und Monopropylamin wird wieder zur ersten Reaktionsstufe zurückgeführt.[3]
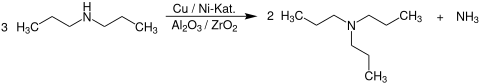
Als Reaktoren werden meist Rohrbündelreaktoren mit Kreisgasstrom und einem Festbett, bei denen Salzschmelzen die Reaktion auf nahezu konstanter Temperatur halten, eingesetzt.[3]
Eigenschaften
Physikalische Eigenschaften
Tripropylamin hat eine relative Gasdichte von 4,94 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,01 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Außerdem weist Tripropylamin einen Dampfdruck von 4,30 hPa bei 20 °C auf.[1]
Chemische Eigenschaften
Tripropylamin ist eine entzündbare farblose Flüssigkeit aus der Stoffgruppe der aliphatischen tertiären Amine. Sie ist sehr schwer löslich in Wasser (0,75 g·l−1 bei 25 °C) und leichter als Wasser. TPA ist schwer bzw. sehr schwer flüchtig. Bei Erhitzen zersetzt es sich zu giftigen Nitrosamine und kann in gefährlicher Weise mit starken Oxidationsmitteln, Säuren, Wasserstoffperoxid, brandfördernden Stoffen, Chlorkohlenwasserstoffen, Nitrilen, Oxiden, Peroxiden sowie Phenolen reagieren. Bei 20 °C weist eine wässrige Lösung von 2,6 g/l einen pH-Wert von 11,4 auf.[1]
Verwendung
Tripropylamin (TPA) ist ein wichtiges chemisches Zwischenprodukt zur Herstellung von Farbstoffen, Katalysatoren, Korrosionsinhibitoren. Außerdem findet es Anwendung in der Pharma- und Kosmetikindustrie. Des Weiteren hat sich TPA zur Herstellung von Quats, die als Phasentransferkatalysatoren verwendet werden, bewährt.
Sicherheitshinweise
Tripropylamin wird hauptsächlich durch die Atemwege und die Haut aufgenommen. Bei Aufnahme kann es zu starken Reizwirkungen auf Haut und Schleimhäute kommen. Zu Reproduktionstoxizität, Mutagenität oder Kanzerogenität sind keine Angaben bekannt. Die Zündtemperatur beträgt 180 °C. Der Stoff fällt somit in die Temperaturklasse T4. Mit einem Flammpunkt von 35 °C gilt Tripropylamin als relativ leicht entflammbar. Daneben weist TPA eine untere Explosionsgrenze von 0,7 Vol-% bei 42 g/cm3 und eine obere Explosionsgrenze von 5,6 Vol-% bei 335 g/m3 auf.[1]
Einzelnachweise
- Eintrag zu Tripropylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Januar 2019. (JavaScript erforderlich)
- David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 562 (eingeschränkte Vorschau in der Google-Buchsuche).
- Kevin Huyghe, Steven Brughmans, Falk Simon, Johann-Peter Melder, Peter Raatz: Verfahren zur Herstellung von Tri-n-propylamin (TPA). In: Google Patents. BASF SE, 30. Juni 2010, abgerufen am 23. Januar 2019.


