Ammoniumtetrafluoroborat
Ammoniumtetrafluoroborat ist eine anorganische chemische Verbindung aus der Gruppe der Ammoniumsalze und Tetrafluoroborate. Als natürliche Mineralbildung ist Ammoniumtetrafluoroborat unter dem Namen Barberiit bekannt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
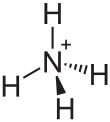 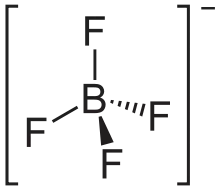 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumtetrafluoroborat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | NH4[BF4] | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,84 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,85 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser unter langsamer Zersetzung[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Ammoniumtetrafluoroborat kann durch Reaktion von Borsäure mit Ammoniumfluorid in Schwefelsäure gewonnen werden.[2] Ebenfalls möglich ist die Darstellung durch Reaktion von Ammoniak mit Fluorborsäure oder Ammoniumbifluorid und Borsäure.[3]
Eigenschaften
Ammoniumtetrafluoroborat ist ein kristalliner weißer geruchloser Feststoff, der leicht löslich in Wasser ist. Er zersetzt sich langsam in Wasser und seine wässrige Lösung reagiert sauer.[1]
Verwendung
Ammoniumtetrafluoroborat wird als analytisches Reagenz verwendet. Es wird auch beim Textil-Druck, Farbenindustrie und als Katalysator eingesetzt. Es dient auch als Hochtemperatur-Flussmittel in der Metallindustrie, als Flammschutzmittel und wirkt als ein festes Schmiermittel in Schneid-Öl-Emulsionen beim Aluminiumwalzen und Umformen.[4] In der Synthese von ionischen Flüssigkeiten dient es als Anionenquelle für das Tetrafluoroborat-Anion.[5]
Einzelnachweise
- Eintrag zu Ammoniumtetrafluoroborat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- M. A. Malati: Experimental Inorganic/Physical Chemistry An Investigative, Integrated Approach to Practical Project Work. Elsevier, 1999, ISBN 978-1-78242-050-7, S. 64 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Ammonium fluoborate in der Hazardous Substances Data Bank, abgerufen am 9. Juli 2016 (online auf PubChem).
- Datenblatt Ammonium tetrafluoroborate, 99.999% (metals basis) bei AlfaAesar, abgerufen am 9. Juli 2016 (PDF) (JavaScript erforderlich).
- Vasudevan V Namboodiri, Rajender S Varma: An improved preparation of 1,3-dialkylimidazolium tetrafluoroborate ionic liquids using microwaves. In: Tetrahedron Letters. Band 43, Nr. 31, 2002, ISSN 0040-4039, S. 5381–5383, doi:10.1016/S0040-4039(02)01075-4.
