Strecker-Abbau
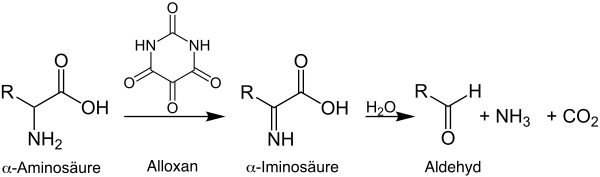
Der Strecker-Abbau ist eine Namensreaktion der organischen Chemie, welche nach dem deutschen Chemiker Adolph Strecker benannt wurde. Die Reaktion beschreibt den irreversiblen, oxidativen Abbau von α-Aminosäuren mit α-Dicarbonylverbindungen zu Aldehyden oder Ketonen, welche um ein Kohlenstoffatom verkürzt sind. In der 1862 erschienenen Originalpublikation von Strecker wurde Alloxan als Oxidationsmittel genutzt und mit Alanin, Leucin sowie Glycin umgesetzt.[1]
Wie später beobachtet wurde, kann die Reaktion katalytisch oder nicht katalytisch erfolgen, wobei den nicht katalysierten Oxidationsreaktionen eine höhere Bedeutung zukommt.[2] Zudem können letztere mit einer Vielzahl organischer oder anorganischer Oxidationsmittel durchgeführt werden. Zu den organischen Oxidationsmitteln zählen z. B. Ketone, Aldehyde oder Peroxycarbonsäuren, während Ozon oder Wasserstoffperoxid in Anwesenheit von Silberoxid oder Eisen(II)-sulfat als anorganische Oxidationsmittel fungieren können.[3]
Reaktionsmechanismus

Mechanistisch erfolgt gemäß vielen Autoren (z. B. Zerong Wang) dabei zunächst die Bildung eines Imins, welches durch die nucleophile Reaktion der Aminogruppe aus der α-Aminosäure mit α-Dicarbonylverbindungen gebildet wird.[5] Anschließend erfolgt eine Decarboxylierung und Hydrolyse des Imins, wobei das um ein Kohlenstoffatom verkürzte Strecker-Aldehyd bzw. Strecker-Keton und Kohlenstoffdioxid gebildet werden.[6] Als Nebenprodukte entstehen Enaminole, welche Folgereaktionen zu Derivaten von Pyridinen, Pyrazinen oder Imidazolen eingehen können.[7] Die Reaktion läuft bei geringeren pH-Werten schneller ab, weil die Carboxylatgruppe schneller protoniert und Kohlenstoffdioxid darum schneller eliminiert werden kann.[2]
Praktische Bedeutung
Der Strecker-Abbau ist auch ein Teilschritt in der Maillard-Reaktion. Die aus der Reaktion hervorgehenden Aldehyde bilden flüchtige Aromakomonenten in Lebensmitteln. Besonders wichtig hierfür ist der Abbau schwefelhaltiger Aminosäuren (z. B. Cystin, Cystein, Methionin), da dabei schwefelhaltige Aldehyde wie Methional entstehen.[7] Die Bindung zwischen den Kohlenstoff- und Schwefelatomen dieser Produkte ist reduktiv leicht zu Schwefelwasserstoff, Alkylmercaptanen, Disulfiden und weiteren Verbindungen spaltbar. In hoher Verdünnung tragen diese zum Aroma vieler Lebensmittel bei (z. B. Zwiebeln, Tomaten, Kartoffeln, Pilze, Fleisch, Brot, Kaffee usw.). Die Entwicklung von Kohlenstoffdioxid während der Maillard-Reaktion wird auf Strecker-Abbau zurückgeführt.[6] Auch für biochemische Prozesse wie z. B. die Entstehung des Lichtgeschmacks von Milch wird die Reaktion verantwortlich gemacht. Darüber hinaus kann die Reaktion zur Synthese von Aldehyden, Ketonen oder α-Aminoketonen verwendet werden.[2]
Einzelnachweise
- Adolph Strecker: Notiz über eine eigenthümliche Oxydation durch Alloxan. In: Annalen der Chemie. 123, Nr. 2, 1862, S. 363–365. doi:10.1002/jlac.18621230312.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. 3. Band. Wiley, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2701–2706.
- Alexander Schönberg, Radwan Moubacher: The Strecker Degradation of α-Amino Acids. In: Chem. Rev.. 50, Nr. 2, 1952, S. 261–277. doi:10.1021/cr60156a002.
- Klaus Roth: Chemische Köstlichkeiten. 1. Auflage. Wiley-VCH, Weinheim 2010, ISBN 978-3-527-32752-2, S. 108.
- Thomas Hofmann, Petra Münch & Peter Schieberle: Quantitative model studies on the formation of aroma-active aldehydes and acids by Strecker-type reactions. In: Journal of agricultural and food chemistry. 48, Nr. 2, 2000, S. 434–440. doi:10.1021/jf990954c.
- Michael Angrick, Dieter Rewicki: Die Maillard-Reaktion. In: Chemie in unserer Zeit. 14, Nr. 5, 1980, S. 149–157. doi:10.1002/ciuz.19800140503.
- Ebermann, R. & Elmadfa, I.: Lehrbuch Lebensmittelchemie und Ernährung. 2. Auflage. Springer, Wien 2011, ISBN 978-3-7091-0210-7, S. 108.
propanal_200.svg.png.webp)