Monochloramin
Monochloramin ist eine chemische Verbindung, die als Desinfektionsmittel eingesetzt wird und zur Gruppe der Chloramine bzw. Stickstoffhalogenide gehört. In reiner Form ist Monochloramin instabil und zersetzt sich bei Temperaturen von über −110 °C; ab −40 °C verläuft die Zersetzung heftig bis explosionsartig. Bei niedrigen Drücken sowie in verdünnten Lösungen ist es stabil.[2]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
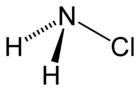 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Monochloramin | |||||||||||||||
| Andere Namen |
Chloramin | |||||||||||||||
| Summenformel | NH2Cl | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 51,48 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Monochloramin kann durch Reaktion von Chlor mit stickstoffhaltigen Verbindungen z. B. in Schwimmbädern entstehen.[4] Es ist, neben anderen Chloraminen, für den typischen Schwimmbadgeruch verantwortlich und kann zu Augen- und Schleimhautreizungen führen.[5]
Gewinnung und Darstellung
Monochloramin kann gewonnen werden durch Reaktion von Ammoniak (oder Ammoniumverbindungen) mit Hypochloriger Säure[6] unter leicht alkalischen Bedingungen:
Die Verwendung von Chlor ist weniger ratsam aufgrund der Bildung explosiven Stickstofftrichlorids als Nebenprodukt.[7]
Verwendung
Monochloramin wird in geringer Konzentration in den USA als Desinfektionsmittel in Wasserversorgungssystemen als Alternative zur Chlorung eingesetzt. Des Weiteren bildet Monochloramin ein wichtiges Zwischenprodukt bei der Hydrazin-Synthese nach dem Raschig-Verfahren. Monochloramin bildet mit Phenolen in Anwesenheit eines Katalysators blaue Indophenolfarbstoffe, was als Nachweis genutzt werden kann.
Sicherheitshinweise
Monochloramin ist giftig für bestimmte Fischarten.[8]
Einzelnachweise
- Eintrag zu Chloramid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Februar 2017. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Chloramide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 27. September 2017.
- Hygieneanforderungen an Bäder und deren Überwachung. In: Bundesgesundheitsblatt. Band 57, Nr. 2, 2014, S. 258–279, doi:10.1007/s00103-013-1899-7 (freier Volltext).
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft. Springer Fachmedien, Wiesbaden 2015, ISBN 978-3-658-07310-7, S. 188, doi:10.1007/978-3-658-07310-7.
- Gordon M. Fair, J. Carrell Morris, Shih Lu Chang, Ira Weil, Robert P. Burden: Behavior of chlorine as a water disinfectant. In: Journal of the American Water Works Association. Band 40, Nr. 10, 1948, S. 1051–1061, JSTOR:41234959.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 477–479.
- Gregory L. Seegert, Arthur S. Brooks, John R. Vande Castle, Kenneth Gradall: The Effects of Monochloramine on Selected Riverine Fishes. In: Transactions of the American Fisheries Society. Band 108, Nr. 1, 1979, S. 88–96, doi:10.1577/1548-8659(1979)1082.0.CO;2.


