Fluorazid
Fluorazid ist eine chemische Verbindung des Fluors aus der Gruppe der Halogenazide bzw. der Stickstoffhalogenide.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
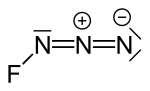 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Fluorazid | ||||||||||||
| Andere Namen |
Triazadienylfluorid | ||||||||||||
| Summenformel | N3F | ||||||||||||
| Kurzbeschreibung |
grüngelbes Gas[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 61,02 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||
| Dichte |
1,3 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
−82 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Unter den Halogenaziden nimmt Fluorazid eine Sonderstellung ein, da seine N3-Gruppe positiv polarisiert ist. Als letzte Verbindung dieser Substanzklasse wurde es 1942 durch Umsetzung von HN3 mit Fluor durch John F. Haller synthetisiert. Da Fluorazid in der Gasphase bei Raumtemperatur zerfällt und im kondensierten Zustand außerordentlich leicht explodiert, gelangen die Reindarstellung und eine nähere Charakterisierung sowie die genaue Bestimmung von spektroskopischen Daten sowie Werten für Schmelz- und Siedepunkt erst in den 1990er-Jahren.[4]
Gewinnung und Darstellung
Fluorazid kann durch Reaktion von Stickstoffwasserstoffsäure mit Fluor gewonnen werden.[5]
Es kann auch durch Reaktion von Natriumazid mit Fluor dargestellt werden.[6]
Eigenschaften
Fluorazid ist ein grüngelbes Gas, das bei 25 °C instabil ist und in Stickstoff(I)-fluorid und Stickstoff zerfällt.[1]
In der flüssigen und festen Form ist die Verbindung extrem explosiv. Bei Raumtemperatur reagierte sie nicht mit Wasser, Sauerstoff, Xenondifluorid, Sauerstoffdifluorid und Trimethylsilylazid. Reaktionen mit Stickstoffmonoxid, Kohlenstoffmonoxid, Carbonylsulfid führen zu Produkten, die sich über die Bildung des NF{a1Δ}-Radicals als Zwischenprodukt interpretieren lassen.[5]
Bei Temperaturen zwischen 40 und 80 °C zerfällt es in Stickstoff(I)-fluorid und Stickstoff(III)-fluorid. Mit Chlor reagiert es zwischen 50 und 85 °C zu Chlordifluoramin und Stickstoff.[7]
Das UV/Vis-Absorptionsspektrum von gasförmigem Fluorazid zeigt analog dem anderer Halogenazide drei Absorptionen λmax = 414, 208 und <190 nm, εmax = 12.800 und > 1200L mol−1cm−1. Das Massenspektrum zeigt eine Ionisationsenergie von 70 eV und ein Ionquellentemperatur von 50 °C.[5] Es wurde angenommen, dass sich aufgrund der geringen NF-Bindungsenergie (<150 kJ/mol) in Fluorazid ein Fluor-Ion unter Bildung eines N3+-Salzes abspalten lassen würde. Dies hätte eine Möglichkeit ergeben, die strukturellen, spektroskopischen und physikalisch-chemischen Eigenschaften dieses bisher präparativ nicht zugänglichen Nichtmetallkations zu analysieren. Allerdings zeigte sich, dass die Fluoriddonator-Eigenschaften nicht ausreichen, in Gegenwart der Lewis-Säuren Bortrifluorid oder Arsenpentafluorid die entsprechenden N3+-Salze zu bilden. Vielmehr entstehen immer nur die Addukte, die eine koordinative (Nα→M)-Bindung (M = B, As) aufweisen.[4] Die Atomabstände im Molekül betragen F-N 144,4 pm, FN-NN 125,3 pm und FNN-N 113,2 pm, die Winkel FNN 103,8° und NNN 170,9°.[8] Es sind auch zwei zyklische Isomere der Verbindung bekannt, bei denen die drei Stickstoffatome einen Ring bilden.[9]
Verwendung
Fluorazid dissoziiert exotherm in Stickstoff und elektronisch angeregte NF-Moleküle, sodass es möglicherweise zum Betrieb energiereicher chemischer Laser eingesetzt werden kann.[4]
Einzelnachweise
- Naumann: Fluor und Fluorverbindungen. Springer-Verlag, 2013, ISBN 978-3-642-72344-5, S. 62 (eingeschränkte Vorschau in der Google-Buchsuche).
- Brener, Nathan E.; Kestner, Neil R.; Callaway, Joseph (December 1990). Theoretical Studies of Highly Energetic CBES Materials: Final Report for the Period 2 March 1987 to 31 May 1987 (PDF). Louisiana State University, Department of Physics and Astronomy. pp. 21–27. Abgerufen am 25. Juni 2014.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Gabriele Schatte, Helge Willner: Die Wechselwirkung von N3F mit Lewis-Säuren und HF. N3F als möglicher Vorläufer für die Synthese von N3+-Salzen / The Interaction of N3F with Lewis-Acids and HF. N3F as Possible Precursor for the Synthesis of N3+ Salts. In: Zeitschrift für Naturforschung B. 46, 1991, doi:10.1515/znb-1991-0410.
- Khodayar Gholivand, Gabriele Schatte, Helge Willner: Properties of triazadienyl fluoride, N3F. In: Inorganic Chemistry. 26, 1987, S. 2137, doi:10.1021/ic00260a025.
- D. J. Benard, B. K. Winker, T. A. Seder, R. H. Cohn: Production of nitrogen monofluoride (a1.DELTA.) by dissociation of fluorine azide. In: The Journal of Physical Chemistry. 93, 1989, S. 4790, doi:10.1021/j100349a022.
- Peter Merlet: Gmelin Handbook of Inorganic Chemistry - Fluorine Compounds with Oxygen and Nitrogen. Springer Science & Business Media, 2013, ISBN 978-3-662-06339-2, S. 406 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dines. Christen, H. G. Mack, G. Schatte, H. Willner: Structure of triazadienyl fluoride, FN3, by microwave, infrared, and ab initio methods. In: Journal of the American Chemical Society. 110, 1988, S. 707, doi:10.1021/ja00211a007.
- Galina Chaban, David R. Yarkony, Mark S. Gordon: On the structure and stability of geometrical isomers of N3F. In: The Journal of Chemical Physics. 103, 1995, S. 7983, doi:10.1063/1.470216.