Stickstoff(I)-fluorid
Stickstoff(I)-fluorid ist eine chemische Verbindung bestehend aus den Elementen Stickstoff und Fluor mit der Summenformel N2F2 und zählt zu den Stickstoffhalogeniden. In der Verbindung besitzt Stickstoff die Oxidationsstufe +1.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
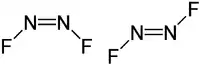 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Stickstoff(I)-fluorid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | N2F2 | ||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 66,01 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Darstellung
Stickstoff(I)-fluorid kann aus der thermischen Zersetzung von Fluorazid erhalten werden. Hierbei zersetzt sich Fluorazid zu Stickstoff(I)-fluorid und molekularem Stickstoff.[1]
Ein weiterer Syntheseweg besteht in der Umsetzung von Difluoramin mit Kaliumfluorid.[1]
Ebenfalls möglich ist die Reaktion von Natriumazid mit Fluor, bei der sich ebenfalls Stickstoff(III)-fluorid bildet.[6]
Alternativ erfolgt die Darstellung über Photolyse von Tetrafluorhydrazin mit Brom[4]:
Eigenschaften
Stickstoff(I)-fluorid ist bei Raumtemperatur ein farbloses Gas mit einem Geruch ähnlich dem von Stickstoffdioxid[6], das über 300 °C in die Elemente zerfällt. Es existieren die cis- und die trans-Form als Isomere, die miteinander im thermodynamischen Gleichgewicht stehen. Die cis-Form ist hierbei das energetisch günstigere Isomer und liegt bei 25 °C zu 90 % vor.[1] Die Verbindung reagiert mit Fluor unter Bildung von Stickstoff(III)-fluorid. Es ist gegen saure und alkalische Hydrolyse vollkommen beständig, wird jedoch von saurer Kaliumiodid-Lösung zersetzt.[6]
Der Abstand zwischen beiden Stickstoffatomen entspricht dem einer Doppelbindung (120,9 pm im cis-, 122,4 pm im trans-Isomer). Die N-F-Bindungslänge beträgt 140,9 pm für das cis- und 139,8 pm für das trans-Isomer, was der erwarteten Bindungslänge für eine Einfachbindung entspricht.[1]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- cis-Stickstoff(I)-fluorid bei webelements.com
- trans-Stickstoff(I)-fluorid bei webelements.com
- Leon M. Zaborowski et al.: Chlorodifluoroamine and Difluorodiazene - B. Difluorodiazene (Dinitrogen difluoride). In: Aaron Wold and John K. Ruff (Hrsg.): Inorganic Syntheses. Band 14. McGraw-Hill Book Company, Inc., 1973, ISBN 07-071320-0 (defekt), S. 34–39 (englisch).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 200.