Stickstofftribromid
Stickstofftribromid ist eine chemische Verbindung, die zur Gruppe der Stickstoffhalogenide gehört. Durch ihre Empfindlichkeit und hohe Explosivität gibt es keine praktische Anwendung für die Verbindung.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
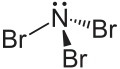 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Stickstofftribromid | ||||||||||||
| Andere Namen |
Tribromamin | ||||||||||||
| Summenformel | NBr3 | ||||||||||||
| Kurzbeschreibung |
dunkelroter, explosiver Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 253,72 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt |
explodiert > −100 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen
Wird bei der Desinfektion von Schwimmbäder anstelle von Chlor Brom eingesetzt, kann durch die Reaktion mit Harnstoff aus menschlichen Ausscheidungen als Nebenprodukt Stickstofftribromid[3][4] entstehen.
Gewinnung und Darstellung
Stickstofftribromid lässt sich gewinnen durch Bromierung von Stickstofftrichlorid[5]
oder durch Umsetzung von Ammoniumbromid, Natriumchlorit und Eisen(III)-bromid
oder durch Reaktion von Bis(trimethylsilyl)bromamin mit Bromchlorid[6] bei −85 °C in Pentan als Lösungsmittel
Auch durch Elektrolyse einer Ammoniumiodid- und Kaliumbromidlösung (NH4I + KBr) kann Stickstofftribromid hergestellt werden.
Bei der Explosion zerfällt Stickstofftribromid in die Elemente:
Literatur
- Jochen Jander: Non-Aqueous Solvents for Preparation and Reactions of Nitrogen Halogen Compounds (PDF; 477 kB). Pure & Appl. Chem., Vol. 49, S. 67–73.
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 702.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- LennTech:Bromine as Desinfectant
- Water Quality and Health Council:Pool Health
- Lateral Science: Fulminating oils (Memento des Originals vom 21. September 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Jochen Jander: Non-Aqueous Solvents for Preparation and Reactions of Nitrogen Halogen Compounds (PDF; 477 kB). Pure Appl. Chem., Vol. 49, S. 67–73.